Дикальцій фосфат — Вікіпедія
| Дикальцій фосфат | |
|---|---|
 | |
 | |
| Назва за IUPAC | calcium hydrogen phosphate |
| Інші назви | calcium hydrogen phosphate, phosphoric acid calcium salt (1:1) |
| Ідентифікатори | |
| Номер CAS | 7757-93-9 |
| PubChem | 104805 |
| Номер EINECS | 231-826-1 |
| ChEBI | 32596 |
| SMILES | O.O.OP(=O)([O-])[O-].[Ca+2] |
| InChI | 1/Ca.H3O4P.2H2O/c;1-5(2,3)4;;/h;(H3,1,2,3,4);2*1H2/q+2;;;/p-2 |
| Властивості | |
| Молекулярна формула | CaHPO4 |
| Молярна маса | 136.06 g/mol (anhydrous) 172.09 (dihydrate) |
| Зовнішній вигляд | white powder |
| Запах | odorless |
| Густина | 2.929 g/cm3 (anhydrous) 2.31 g/cm3 (dihydrate) |
| Тпл | decomposes |
| Розчинність (вода) | 0.02 g/100 mL (anhydrous) 0.02 g/100 mL (dihydrate) |
| Структура | |
| Кристалічна структура | triclinic |
| Небезпеки | |
| NFPA 704 | |
| Температура спалаху | Non-flammable |
| Пов'язані речовини | |
| Інші аніони | Calcium pyrophosphate[en] |
| Інші катіони | Magnesium phosphate[en] Монокальцій фосфат Ортофосфат кальцію Ортофосфат стронцію[ru] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Дикальцій фосфат — це фосфат кальцію з формулою CaHPO4 та його дигідрат. Префікс «ди» в загальній назві виникає внаслідок утворення аніону HPO42– шляхом видалення двох протонів з фосфатної кислоти, H3PO4. Назвами-синонімами є кальцію фосфат двоосновний або моногідрофосфат кальцію. Дикальцій фосфат використовується як харчова добавка, входить до складу деяких зубних паст як поліруючий засіб і є біоматеріалом[1][2].
Двоосновний фосфат кальцію отримують шляхом нейтралізації гідроксиду кальцію фосфорною кислотою, яка осаджує дигідрат у вигляді твердої речовини. За температури 60 °C безводна форма випадає в осад:[3]
Для запобігання деградації, яка призвела б до утворення гідроксиапатиту, додають пірофосфат натрію або октагідрат фосфату тримагнію, коли, наприклад, дигідрат двоосновного фосфату кальцію потрібно використати як поліруючий агент у зубній пасті[1].
У безперервному процесі CaCl2 можна обробити (NH4 )2HPO4 з утворенням дигідрату:
Потім суспензію дигідрату нагрівають приблизно до 65–70 °C з утворенням безводного CaHPO4 у вигляді кристалічного осаду, зазвичай у вигляді плоских алмазоїдних кристалів, які придатні для подальшої обробки[4].
Дигідрат двоосновного фосфату кальцію утворюється в "брушитних" кальцій-фосфатних цементах (КФЦ), які використовують у медицині. Прикладом загальної реакції схоплювання під час формування кальцієво-фосфатних цементів «β-ТКФ/МКФ» (β- трикальційфосфат / монокальційфосфат ) є:[5]

Відомі три форми дикальцій фосфату:
- дигідрат, CaHPO4•2H2O ("DPCD"), мінерал брушит
- моногідрат, CaHPO4•H2O ("DCPM")
- безводний CaHPO4, ("DCPA"), мінерал монетит . Нижче pH 4,8 дигідрат і безводна форми дикальцій фосфату є найбільш стабільними (нерозчинними) з фосфатів кальцію.
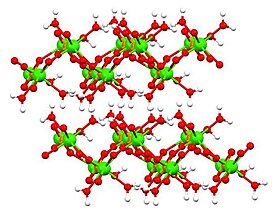
Структуру безводної та дигідратованої форм визначили за допомогою методу рентгеноструктурного аналізу, а структуру моногідрату – електронною кристалографією. Дигідрат[6] (показаний у таблиці вище), а також моногідрат[7] мають шарувату структуру.
Двоосновний фосфат кальцію в основному використовується як дієтична добавка у готових сухих сніданках, ласощах для собак, збагаченого борошна та виробів з локшини. Його також використовують як засіб для таблетування в деяких фармацевтичних препаратах, зокрема деяких засобів, призначених для усунення запаху тіла. Двоосновний фосфат кальцію також міститься в деяких харчових добавках кальцію (наприклад, Бонекцин). Використовується в кормі для птиці. А також в деяких зубних пастах - як засіб для контролю зубного каменю[8].
У разі нагрівання дикальційфосфат переходить у дикальційдифосфат, корисний поліруючий агент:
У формі дигідрату (брушиту) він міститься в деяких каменях у нирках і зубних каменях[3][9].
- ↑ а б CHAPTER 3 - Phosphates. Studies in Inorganic Chemistry (англ.). Т. 20. Elsevier. 1 січня 1995. с. 169—305. doi:10.1016/b978-0-444-89307-9.50008-8.
- ↑ Salinas, Antonio J.; Vallet-Regí, María (2013). Bioactive ceramics: From bone grafts to tissue engineering. RSC Advances. 3 (28): 11116. Bibcode:2013RSCAd...311116S. doi:10.1039/C3RA00166K.
- ↑ а б Rey, C.; Combes, C.; Drouet, C.; Grossin, D. (1 січня 2011). Ducheyne, Paul (ред.). 1.111 - Bioactive Ceramics: Physical Chemistry. Comprehensive Biomaterials (англ.). Oxford: Elsevier. с. 187—221. doi:10.1016/b978-0-08-055294-1.00178-1. ISBN 978-0-08-055294-1.
- ↑ Ropp, R.C. (2013). Group 15 (N, P, As, Sb and Bi) Alkaline Earth Compounds. Encyclopedia of the Alkaline Earth Compounds. с. 199—350. doi:10.1016/B978-0-444-59550-8.00004-1. ISBN 9780444595508.
- ↑ Tamimi, Faleh; Sheikh, Zeeshan; Barralet, Jake (2012). Dicalcium phosphate cements: Brushite and monetite. Acta Biomaterialia. 8 (2): 474—487. doi:10.1016/j.actbio.2011.08.005. PMID 21856456.
- ↑ Curry, N. A.; Jones, D. W. (1971). Crystal structure of brushite, calcium hydrogen orthophosphate dihydrate: A neutron-diffraction investigation. Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 3725. doi:10.1039/J19710003725.
- ↑ Lu, Bing-Qiang; Willhammar, Tom; Sun, Ben-Ben; Hedin, Niklas; Gale, Julian D.; Gebauer, Denis (24 березня 2020). Introducing the crystalline phase of dicalcium phosphate monohydrate. Nature Communications (англ.). 11 (1): 1546. Bibcode:2020NatCo..11.1546L. doi:10.1038/s41467-020-15333-6. ISSN 2041-1723. PMC 7093545. PMID 32210234.
- ↑ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). Phosphoric Acid and Phosphates. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a19_465.pub3. ISBN 978-3527306732.
- ↑ Pak, Charles Y.C.; Poindexter, John R.; Adams-Huet, Beverley; Pearle, Margaret S. (2003). Predictive value of kidney stone composition in the detection of metabolic abnormalities. The American Journal of Medicine. 115 (1): 26—32. doi:10.1016/S0002-9343(03)00201-8. PMID 12867231.


 French
French Deutsch
Deutsch