六氟化鎝 - 维基百科,自由的百科全书
| 六氟化鎝 | |
|---|---|
 | |
| IUPAC名 Technetium(VI) fluoride | |
| 识别 | |
| CAS号 | 13842-93-8 |
| PubChem | 57470148 |
| SMILES |
|
| InChIKey | PRVOBRCYHYXCMU-UHFFFAOYSA-H |
| 性质 | |
| 化学式 | TcF6 |
| 摩尔质量 | 212 g/mol (98Tc) g·mol⁻¹ |
| 外观 | 金黃色晶體[1] |
| 密度 | 3.58 g/cm3 (−140 °C、固態)[2] |
| 熔点 | 37.4 °C(311 K) |
| 沸点 | 55.3 °C(328 K) |
| 结构 | |
| 晶体结构 | 立方晶系 |
| 危险性 | |
| 欧盟分类 | 不在名單中 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
六氟化鎝是一個低熔點的金黃色無機化合物[1],其化學式為TcF6,發現於1961年[3]。在這化合物中,鎝有+6價,是目前發現的鎝化合物中,氧化價最高的2個鹵化物之一,另一個是六氯化鎝(Technetium(VI) chloride, TcCl6)。其中,這裡的鎝與形成七氟化錸(ReF7)的錸不同[4]。六氟化鎝會出現在六氟化鈾的雜質中,因為鎝是鈾的裂變產物。
製備
[编辑]製備六氟化鎝的方式是將鎝金屬和過量的氟氣(F2)加熱到攝氏400度。[3]
- Tc + 3 F
2 → TcF
6
特徵
[编辑]六氟化鎝在室溫下為金黃色固體。其熔點较低,約為37.4℃[1],當環境溫度高於38℃就會熔化,沸點為55.3℃[1],其在標準狀態下液相的範圍不大,僅有17.9℃。
六氟化鎝在−4.54 °C會發生一次相變,高於該溫度時,晶體結構為立方晶系,其晶格常數 a 為 6.16 Å[註 1]。每單位晶格有兩個化学式单位[註 2],其密度為3.02 g·cm−3;而低於該溫度時,晶體結構為正交晶系,其晶格常數a 為 9.55 Å、b 為 8.74 Å,、c 為 5.02 Å[註 3]。每單位晶格有四個化学式单位[註 2],其密度為3.38 g·cm−3。而當溫度降到了攝氏−140℃時,晶格雖然保持為正交晶系,但晶格常數改變了,a 變為 9.360 Å、b 變為 8.517 Å而c 則變為 4.934 Å,密度也改變了,變為3.58 g·cm−3。[2]
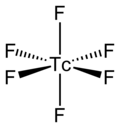
而TcF6的分子本身[註 4]的分子結構為八面体形分子构型,點群為八面體對稱(Oh)、Tc-F鍵的鍵長為1.812Å[2]、其磁矩測量值為0.45 μB[5]。
性質
[编辑]由於鎝沒有穩定的同位素,因此六氟化鎝具有放射性,常溫下為黃色固體。
物理
[编辑]六氟化鎝在红外光谱学和拉曼光譜學的測定下呈現八面体形分子构型[6][7]。在低溫下,六氟化鎝和其他金屬的六氟化物(如六氟化銠、六氟化鋨)一樣,會從室溫的高對稱性立方晶系結構轉換成正交晶系結構[8]。其磁矩初步測量的數值約為0.45μB,比預期的d1八面體化合物來得低[9]。
化學
[编辑]六氟化鎝在五氟化碘(IF5)溶液中能與鹼性的氯反應形成六氟化物 [10][11]。六氟化鎝會在氫氧化鈉的水溶液(NaOH(aq))中水解,並形成黑色的二氧化鎝(TcO2)沉澱[3] 。在氟化氫(HF)溶液中,六氟化鎝會與氟化肼(hydrazinium fluoride、N2H5F)反應,得到N2H6TcF6或N2H6(TcF6)2[12]。
註解
[编辑]參考文獻
[编辑]- ^ 1.0 1.1 1.2 1.3 CRC Handbook of Chemistry and Physics, 90th Edition, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-93.
- ^ 2.0 2.1 2.2 Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. Solid State Molecular Structures of Transition Metal Hexafluorides. Inorganic Chemistry. 2006, 45 (9): 3782–3788. PMID 16634614. doi:10.1021/ic052029f.
- ^ 3.0 3.1 3.2 Selig, H.; Chernick, C.L.; Malm, J.G. The Preparation and Properties of TcF6. Journal of Inorganic and Nuclear Chemistry. 1961, 19 (3–4): 377–381.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Selig, H.; Cafasso, F. A.; Gruen, D. M.; Malm, J. G. Magnetic Susceptibility of ReF6. Journal of Chemical Physics. 1962, 36 (12): 3440. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- ^ Howard H. Claassen; Henry Selig & John G. Malm. Vibrational Spectra of MoF6 and TcF6. Journal of Chemical Physics. 1962, 36 (11): 2888–2890. Bibcode:1962JChPh..36.2888C. doi:10.1063/1.1732396.
- ^ Howard H. Claassen; Gordon L. Goodman; John H. Holloway & Henry Selig. Raman Spectra of MoF6, TcF6, ReF6, UF6, SF6, SeF6, and TeF6 in the Vapor State. Journal of Chemical Physics. 1970, 53 (1): 341–348. Bibcode:1970JChPh..53..341C. doi:10.1063/1.1673786.
- ^ Siegel S & Northrop DA. X-Ray Diffraction Studies of Some Transition Metal Hexafluorides. Inorganic Chemistry. 1966, 5 (12): 2187–2188. doi:10.1021/ic50046a025.
- ^ Selig, H; Cafasso, F A.; Gruen, D M.; Malm, J G. Magnetic Susceptibility of ReF6. Journal of Chemical Physics. 1962, 36 (12): 3440–3444. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- ^ Edwards, A. J.; Hugill, D.; Peacock, R. D. New Fluorine Compounds of Technetium. Nature. 1963, 200 (4907): 672. Bibcode:1963Natur.200..672E. doi:10.1038/200672a0.
- ^ D. Hugill & R. D. Peacock. Some quinquevalent fluorotechnetates. Journal of the Chemical Society A. 1966: 1339–1341. doi:10.1039/J19660001339.
- ^ Frlec B; Selig H & Hyman H.H. Hydrazinium(+2) Hexafluorometalates(IV) and -(V) in the 4d and 5d Transition Series. Inorganic Chemistry. 1967, 6 (10): 1775–1783. doi:10.1021/ic50056a004.


 French
French Deutsch
Deutsch