Глицерин – Уикипедия
| Глицерин | |
| Свойства | |
|---|---|
| Формула | C₃H₈O₃ |
| Моларна маса | 92,047 u[1] |
| Плътност | 1,26 g/cm³ (20 °C)[2] |
| Точка на топене | 18 °C |
| Точка на кипене | 290 °C |
| Парно налягане | 0,40 Pa (50 °C) |
| Показател на пречупване | 1,66 |
| Опасности | |
| NFPA 704 |
|
| Точка на запалване | 160 °C |
| Идентификатори | |
| CAS номер | 56-81-5 |
| PubChem | 753 |
| ChemSpider | 733 |
| DrugBank | DB09462 |
| KEGG | D00028 |
| MeSH | D005990 |
| ChEBI | 17754 |
| ChEMBL | CHEMBL692 |
| RTECS | MA8050000 |
| ATC | A06AX01 |
| SMILES | C(C(CO)O)O |
| InChI | InChI=1S/C3H8O3/c4-1-3(6)2-5/h3-6H,1-2H2 |
| InChI ключ | PEDCQBHIVMGVHV-UHFFFAOYSA-N |
| UNII | PDC6A3C0OX |
| Gmelin | 26279 |
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |
| Глицерин в Общомедия | |
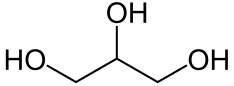
Глицерин е тривиалното име на съединението 1,2,3-пропантриол, известно още като 1,2,3-трихидроксипропан (HOCH2CH(OH)-CH2OH), което представлява тривалентен алифатен алкохол. Друго, също разпространено, име за същото вещество е глицерол, въведено с цел да се подчертае алкохолния характер на глицерина (наставката – ол се използва в химията за означаване на алкохоли).
Получава се при хидролиза на природни мазнини и масла. За първи път е получен от Карл Шееле през 1779 г. при осапунване на мазнини.
Физични свойства
[редактиране | редактиране на кода]Глицеролът е безцветна трудноподвижна течност, по-тежка от водата. Има сладък вкус, който е дал и тривиалното му наименование (от гр. гликерос – сладникав). Сладникавият вкус се дължи на натрупването на хидроксилни групи в молекулата на съединението. Във водата глицеролът се разтваря във всяко отношение, нещо повече, той е хигроскопичен. Затова, прибавен към смеси, ги прави по-трудно съхливи.
Ако на 1,2,3-трихлоропропан се действа с водна пара, протича процес, който може да се представи с уравнението:
От тази синтеза се вижда, че глицеролът може да се разглежда като получен от пропан, в молекулата на който по един водороден атом при всеки въглероден е заместен с хидроксилна група. Понеже глицеролът съдържа хидроксилни групи, той също е алкохол, но за разлика от етиловия, той е многовалентен алкохол. Както при етиловия алкохол, функционалните групи на това съединение са хидроксилните.

Химични свойства
[редактиране | редактиране на кода]Свойства на глицерола, определени от хидроксилните групи
[редактиране | редактиране на кода]Глицеролът взаимодейства с активни метали. При взаимодействието му с натрий се получава съединението натриев глицерат и се отделя водород:
Естерификация
[редактиране | редактиране на кода]Глицеролът, както и етиловият алкохол, се естерифицират. С концентрирана азотна киселина в присъствие на се образува веществото глицеролов тринитрат (нитроглицерин):
Горене
[редактиране | редактиране на кода]Парите на глицерола горят с безцветен пламък, поради наличието на повече кислород в молекулата му.
Получаване
[редактиране | редактиране на кода]Обичайната суровина за производството на глицерол са триглицеридите – три естера на дълговерижни карбоксилни киселини (мастни киселини), свързани с една молекула глицерол.
Основен източник на триглицериди са животински мазнини (лой) и растителни масла (палмово или соево). Възможно и е използването на нефт, но то е икономически неизгодно.
Суров глицерол се получава чрез хидролиза на триглицериди. Това става чрез два вида химични процеси:
- Осапунване – триглицеридите се смесват с основа (калиев или натриев хидроксид), което води до химичното им разпадане на глицерол и соли на мастните киселини (сапун).
- Трансестерификация (основен процес в производството на биогориво) – триглицеридите се смесват с алкохол (етилов или метилов) в присъствие на катализираща основа (калиев или натриев хидроксид), при която мастните киселини се свърват с хидроксилната група на алкохола в моноалкилни естери (биодизел), освобождавайки глицерола. Така глицеролът се явява остатъчен продукт при производството на биогорива. Съгласно Директива 2009/28/ЕО на ЕП и на Съвета от 23 април 2009 година за насърчаване използването на енергия от възобновяеми източници и за изменение и впоследствие за отмяна на директиви 2001/77/ЕО и 2003/30/ЕО[3] се постави изискване за присъствие на биокомпонент в петролните горива във всички държави членки на Европейския съюз. Това води и до нарастване на производството на глицерол и намаляване на цената му.
Суровият глицерол може да бъдат пречистен, но процесът е скъп. Пречистването става чрез третиране с активен въглен за отстраняване на органични примеси, алкали за отстраняване на нереагирали глицеролови естери и йонен обмен за отстраняване на соли. Глицерол с висока чистота (> 99,5%) се получава чрез многоетапна дестилация под вакуум, поради високата точка на кипене на глицерола (290 °С).[4]
Годишното производство на глицерол в САЩ и Европа е около 950 хил. тона годишно.[5]
Глицеролът може да се изгаря, но неговата топлинна стойност е ниска.[6]
Физиологично действие и употреба
[редактиране | редактиране на кода]Глицеролът е гъста безцветна течност със сладникав вкус и добра разтворимост във вода. Притежава дехидратиращи свойства, дължащи се на засилена реабсорбция на вода и увеличено плазмено налягане, което води до отделянето на голямо количество течност, поради което е забранен за вътрешна употреба при проблеми с бъбреците и нарушено кръвообращение. Повишеният прием на веществото може да доведе до силно обезводняване на организма. При външно приложение в малки количества омекотява и подхранва кожата, но поради силната си хигроскопичност чистият глицерол ще я изсуши.[7]
Глицеролът се употребява в:[7]
- Хранителната индустрия (като хранителна добавка Е422) – стабилизатор, който запазва и увеличава вискозитета и консистенцията на хранителните продукти, и емулгатор при смесване на иначе несъединими при други условия вещества. Поради лаксативния ефект при прекомерната му употреба е разрешен в ограничени количества.
- Производството на алкохолни напитки.
- Медицината и криобиологията – като слабително и диуретично средство.
- Козметиката – като съставка в много козметични средства и сапуни.
- Производството на взривни вещества (виж нитроглицерин).
- Обработката на кожени изделия.
- Направата на хартия.
- Производството на антифриз.
- Течности за сапунени балони.
Източници
[редактиране | редактиране на кода]- ↑ glycerol // PubChem. Посетен на 19 октомври 2016 г. (на английски)
- ↑ www.cdc.gov
- ↑ Официален вестник на Европейския съюз
- ↑ Ullmann's Encyclopedia of Industrial Chemistry // Ullmann's Encyclopedia of Industrial Chemistry. 2006. ISBN 3527306730. DOI:10.1002/14356007.a12_477.pub2.
- ↑ Nilles, Dave. A Glycerin Factor // Biodiesel Magazine, 2005. Архивиран от оригинала на 2007-11-08. Посетен на 2019-04-09.
- ↑ Sims, Bryan. Clearing the way for byproduct quality: why quality for glycerin is just as important for biodiesel // Biodiesel Magazine. 25 October 2011.
- ↑ а б E422 – Глицерол (Glycerol)
- Тази статия се основава на материал, публикуван във Органичната химия в мрежата, използван с разрешение на автора.


 French
French Deutsch
Deutsch