Метал – Уикипедия


Металите (от старогръцки: μέταλλον, „мина, метал“) са група вещества, които в чист вид имат блестяща повърхност и провеждат относително добре електричество и топлина. Те обикновено са ковки (могат да се изковат в тънки листове) или дуктилни (могат да се изтеглят в телове).[1] Металите могат да бъдат химични елементи като желязото, сплави като неръждаемата стомана или молекулярни съединения като политиазила.
В науката няма твърдо определена дефиниция за металите, като границите между метали, неметали и металоиди варира до известна степен в различни интерпретации. В химията обикновено около 95 от 118-те елемента в периодичната таблица се смятат за метали – най-често се приема, че те са разположени наляво и под диагоналната линия от бор до полоний (вдясно и над нея се намират неметалите, а по самата граница – металоидите). В кристалните решетки на металите всеки атом е обкръжен от максимално геометрично допустим брой атоми, между които валентните електрони се движат свободно – така нареченият електронен газ.[2]
Във физиката за метали се смятат всички вещества, които провеждат електричество при абсолютната нула на температурата.[3] В този смисъл много неметални вещества могат да се преобразуват в метални при високо налягане. Например, неметалът йод постепенно се превръща в метал при налягане между 40 и 170 хиляди атмосфери. Обратното, някои метални вещества могат да се трансформират в неметали – така натрият става неметал при налягане малко по-ниско от 2 милиона атмосфери.
В астрофизиката терминът „метал“ има още по-широко значение и обхваща всички химични елементи в звездите, които са по-тежки от двата най-леки – водород и хелий. В това значение първите четири метала, формиращи се в звездните ядра чрез нуклеосинтез, са въглеродът, азотът, кислородът и неонът, които са стриктно неметални в химията. За астрофизиците металичността на даден астрономически обект е делът в състава му на по-тежките химични елементи.[4]
Металите като химични елементи съставляват 25% от земната кора и присъстват в много страни на съвременния живот. На Земята се срещат най-често във вид на руди, най-често оксиди, сулфиди и карбонати, от които чистият метал се извлича чрез редукция при високи температури. Якостта и устойчивостта на някои метали е довела до честата им употреба в строителството, повечето превозни средства, много битови уреди, инструменти, тръби. Благородните метали са използвани в миналото за изработката на монети, но в наши дни монетните метали обхващат най-малко 23 от химичните елементи.[5] Около 3% от човешкия организъм се състои от метали.
Смята се, че историята на рафинираните метали започва с използването на медта преди около 11 хиляди години. Златото, среброто, желязото (като метеоритно желязо), оловото и месингът също се използват преди първата известна поява на бронза през V хилядолетие пр. Хр. Впоследствие се започва производството на първите ранни форми на стомана, откриването на натрия, първият лек метал, през 1809 година, развитието на съвременните легирани стомани и от средата на XX век разработването на по-сложни и усъвършенствани сплави.
Характеристики
[редактиране | редактиране на кода]| Метал | Относително тегло | Температура на топене |
|---|---|---|
| Злато | 19,32 | 1063 °C |
| Платина | 21,6 | 1780 °C |
| Олово | 11,3 | 327 °C |
| Живак | 13,5 | - 39 °C |
| Сребро | 10,5 | 960 °C |
| Мед | 8,9 | 1083 °C |
| Желязо | 7,9 | 1539 °C |
| Калай | 7,3 | 232 °C |
| Цинк | 7,14 | 419 °C |
| Алуминий | 2,7 | 660 °C |
Строеж
[редактиране | редактиране на кода]
Металната кристална решетка е изградена само от катиони. Стабилността ѝ е обособена от особен вид химична връзка, присъща само на металите в твърдо и течно агрегатно състояние. Металите притежават редица общи свойства: висока електро- и топлопроводимост, висока пластичност, способност да отразяват голяма част от падналите върху тях светлинни лъчи, които не са присъщи на останалите кристални тела. Тези физични характеристики на металите се дължат на свободно движещите се в металните кристали електрони.
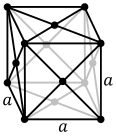
Атомите на металните вещества обикновено са подредени в една от три основни кристални стурктури – кубична обемноцетрирана, кубична стенноцентрирана и хексагонална. При кубичната обемноцентрирана решетка всеки атом е разположен в центъра на куб, образуван от осем други атома, в другите два варианта всеки атом е ограден от дванадесет други, като разположението им е различно. Някои метали имат различна структура в зависимост от температурата.[6]
- Кубична обемноцентрирана кристална решетка с двуатомна клетка, като при хром, желязо и волфрам
- Кубична стенноцентрирана кристална решетка с четириатомна клетка, като при алуминий, мед и злато
- Хексагонална кристална решетка с шестатомна клетка, като при титан, кобалт и цинк
Свойствата на металите произтичат от способността на съответните метални атоми лесно да губят външната си електронна обвивка. Като цяло силите, задържащи на място външната електронна обвивка на отделния атом, са по-слаби от привличащите сили, действащи върху същите електрони в резултат на взаимодействията между атомите в твърдия или течен метал. Тези електрони се делокализират и структурата на метала може да се опише като сбор от атоми, потопени в облак от относително подвижни електрони. Такова взаимодействие се нарича метална връзка.[2] Силата на металните връзки за различните елементни метали достига своя максимум в средата на подгрупата на преходните метали, където елементите имат голям брой делокализирани електрони. Освен положението в периодичната система влияние върху силата на металните връзки оказват и други фактори, като атомния радиус, заряда на ядрото, броят на свързаните орбитали, застъпването на орбиталните енергии и кристалната структура.[2]
Физични свойства
[редактиране | редактиране на кода]
Металите са твърди вещества (с изключение на живака) с висока електропроводимост и топлопроводимост, ковкост и пластичност. Повечето имат висока температура на топене, но например калаят и оловото могат да се разтопят на обикновен котлон. Имат характерен метален блясък, когато са произведени, полирани или отчупени. В прахообразно състояние обаче металите загубват блясъка си, с изключение на алуминий и магнезий, които го запазват дори в това състояние. Най-добре отразяват светлината алуминият, среброто и паладият, затова те се използват при направата на огледала. Цветът на повечето метали е един и същ – светлосив със синкави оттенъци. Изключение са златото – с жълтеникав цвят, медта с червеникав и цезия със светложълт. Металните листове с дебелина повече от няколко микрометра са непрозрачни, но златният варак пропуска зелена светлина.
Макар повечето елементни метали да имат по-висока плътност от повечето неметали,[2] плътността им варира в широки граници – от лития с плътност 0,534 g/cm³ до осмия с плътност 22,59 g/cm³. Магнезият, алуминият и титанът са леки метали с голямо стопанско значение – техните плътности, съответно 1,7, 2,7 и 4,5 g/cm³, са значително по-ниски от тези на други конструктивни метали като желязото със 7,9 g/cm³ или медта с 8,9 g/cm³. Друго свойство на металите е способността им към взаимно разтваряне или свързване, при което се получават сплави.
Това, че металите са добри проводници на електрически ток, се дължи на наличието на подвижни електрони, които се придвижват под действието на електрическото поле. Електроните в материята могат да имат само определени енергийни нива, а при металите техните енергийни нива в електронния облак, поне до известна степен, съответстват на енергийните нива, при които може да се провежда електричество. При полупроводниците като силиция и неметалите като сярата съществува енергийна празнина между електроните на съответното вещество и енергийното ниво, при което възниква електропроводимост, поради което полупроводниците и неметалите са относително лоши проводници.
Елементните метали имат специфична електропроводимост, варираща от 6,9 × 103 S/cm при мангана до 6,3 × 105 S/cm при среброто. За сравнение полупроводниковият металоид бор има специфична електропроводимост 1,5 × 10−6 S/cm. Металите с най-висока електропроводимост, наред със среброто, са мед, злато и алуминий. Металите намаляват електропроводимостта си при загряване, с изключение на плутония, чиято електропроводимост нараства при нагряване в интервала от −175 до +125 °C.
Високата топлопроводимост на металите също произтича от подвижността на електроните в електронния облак и тяхната способност лесно да предават създаваната от топлината вибрационна енергия. По тази причина най-добрият проводник на топлина е също среброто.
По отношение на магнитните си свойства биват диамагнитни, парамагнитни или феромагнитни. В твърдо състояние металите имат високосиметричен кристален строеж.
Механични свойства
[редактиране | редактиране на кода]Повечето метали са ковки и дуктилни, деформиращи се под напрежение без цепене.[2] Смята се, че неориентираната в пространството природа на металните връзки допринася значително за дуктилността на повечето твърди метали. Обратно, при йонни съединения, като готварската сол, където равнините на йонната връзка се приплъзват една спрямо друга, се получава промяна във взаимното положение на близко разположени йони с еднакъв заряд, което води до цепене на кристала. Такова изместване не се наблюдава при ковалентно свързани кристали, като диаманта, при които обаче се получава крехко разрушение и фрагментиране на кристала.[7] Обратимите еластични деформации на металите могат да се опишат със закона на Хук (линейна връзка между напрежения и деформации).

Напрежения, надхвърлящи границата на еластичност, могат да предизвикат постоянни (необратими) деформации, наричани пластични. Подобни ефекти могат да се получат и при нагряване, като температурата може да предизвика изместване на структурни дефекти в метала, като междузърнести граници, дислокации, двойници, които да доведат до пълзене и умора.
Друга механична характеристика на металите е якостта. Теоретичната якост на металите се установява като се използва аналог между структурата на металите и йонната кристална решетка от типа на NaCl. Различието се състои в това, че колективизираните електрони не са съсредоточени в една точка, а са равномерно разпределени в областите между положителните йони. Техническата якост (експерименталната) е на 2 – 4 порядъка по-ниска от теоретично определената.
Химични свойства
[редактиране | редактиране на кода]
За повечето метали е характерна склонността им да отдават електрони при химичното си взаимодействие с неметалите (имат 1 – 4 валентни електрона), при което преминават в положително натоварени йони (катиони).[2] С кислорода образуват главно основни оксиди, повечето от които са анхидриди на съответни основи.
- 4 Na + O2 → 2 Na2O (динатриев оксид)
- 2 Ca + O2 → 2 CaO (калциев оксид)
- 4 Al + 3 O2 → 2 Al2O3 (диалуминиев триоксид)
Изключение са оксидите с много високи степени на окисление като CrO3, Mn2O7 и OsO4, които са силно киселинни.
Повечето метали реагират със съдържащия се във въздуха кислород, макар и с различна скорост – калият се запалва за секунди, докато желязото ръждясва в продължение на години. Други метали като паладия, платината и златото изобщо не реагират с атмосферата. При някои метали, най-вече желязото и неговите сплави, оксидацията при контакт с въздуха предизвиква корозия, за предотвратяването на която те се обработват чрез боядисване, анодиране или плакиране.
Някои метали като титан, алуминий или цинк образуват тънък и плътен оксиден слой на повърхността, който служи като бариера за по-нататъшното проникване на кислородните атоми и по-този начин предотвратяват корозията. При използването на метално покритие за корозионна защита върху основния метал трябва да се нанесе по-реактивен метал, особено когато е възможно нараняване на покритието. Така водата и двата метала образуват електрохимична клетка, при което, докато по-реактивният метал оксидира, по-нереактивният остава защитен от оксидация.
Всички метали се разтварят в киселини, а някои и в основи. Някои метали са силно реактивни и предизвикват бурни реакции с вода.
Сплави
[редактиране | редактиране на кода]
Сплавите са вещества с метални свойства, съставени от два или повече химични елемента, поне един от които е метал. Сплавите могат да имат променлив или фиксиран състав – така златото и среброто могат да образуват сплави в произволно съотношение на двата метала, докато титанът и силицият образуват интерметалидната сплав Ti2Si, в която съотношението на двата компонента е фиксирано. Елементите, образуващи сплавите, (компоненти на сплавите) или изграждат свои индивидуални кристали (образувайки по този начин кристален конгломерат – кристална смес), или атомите им изграждат съвместно нови кристали (смесени кристали, твърди разтвори), или образуват помежду си химични съединения.
Повечето чисти метали са твърде меки, крехки или химически неустойчиви за практическа употреба. Съчетаването в различни съотношения на металите в сплави изменя свойствата на чистите метали, за да се получат определени желани свойства. Целта на изготвянето на сплави обикновено е да се получи метал, който е по-жилав, по-твърд, по-устойчив на корозия или с желан цвят и текстура. Сред използваните в наши дни метални сплави най-голям дял както като количество, така и като стойност, имат сплавите на желязото – стомана, неръждаема стомана, чугун, инструментална стомана, легирана стомана и други. Желязото в сплав с различни съотношения въглерод дава ниско, средно и високовъглеродни стомани, като нарастването на нивата на стомана намалява дуктилността и здравината. Наличието на силиций дава чугуни, а добавянето на повече от 10% хром, никел или молибден – неръждаеми стомани.
Други важни метални сплави са тези на алуминия, титана, медта и магнезия. Сплавите на медта са известни от праисторията – бронзът дава името на бронзовата епоха – и имат много приложения и в наши дни, най-вече в електротехниката. Сплавите на другите три елемента са разработени сравнително скоро, като тяхната химична активност налага използването на електролитни технологии за производство. Те са ценени заради много доброто съотношение на якост към обемно тегло, намирайки приложение в аерокосмическата и друга транспортна техника. Специфични сплави, разработени за приложения с изключително високи изисквания като турбореактивните двигатели, могат да имат изключително сложен състав, включвайки повече от десет елемента.
Класификация
[редактиране | редактиране на кода]Металите могат да бъдат класифицирани по множество различни критерии, сред които:
- Положение в периодичната система – разделят се на алкални, алкалоземни, преходни, постпреходни, лантаниди и актиниди
- Съдържание на желязо – черните метали съдържат съществени количества желязо, а цветните не
- Крехкост – макар повечето метали да са дуктилни, някои от тях са крехки – берилий, хром, манган, галий, бисмут
- Температура на топене – металите с особено висока температура на топене се наричат огнеупорни (обикновено към групата се отнасят ниобий, молибден, тантал, волфрам и рений)
- Обемна маса – разделят се на тежки и леки – няма общоприета стойност на границата между тях, но често се използва стойността от 5 g/cm³
- Корозионна устойчивост – разделят се на неблагородни (податливи на корозия) и благородни (рутений, родий, паладий, осмий, иридий, платина и злато, а в някои класификации също сребро, рений и живак)
- Цена – ценните метали имат особено висока стопанска стойност – злато, сребро, платина, паладий
Жизнен цикъл
[редактиране | редактиране на кода]Формиране
[редактиране | редактиране на кода]Металните химични елементи, до зоната на желязото в периодичната система, като цяло се формират при зведния нуклеосинтез. При този процес по-леките елементи, от водород до силиций, са подложени в звездите на последователни реакции на ядрен синтез, излъчвайки светлина и топлина и формирайки по-тежки елементи с по-големи атомни номера.[8]
В повечето случаи по-тежките метали не се образуват по този начин, тъй като ядреният синтез с участието на толкова тежки ядра би поглъщал енегия, вместо да я освобождава.[9] По тази причина тежките метали най-често са резултат на синтез от по-леки елементи чрез поглъщане на неутрони, чиито две основни форми са s-процесът и r-процесът. При s-процеса отделните поглъщания са раздалечени във времето с години или десетилетия, давайки възможност на по-нестабилното ядро да претърпи бета-разпад,[10] докато при r-процеса поглъщанията протичат по-бързо от способността за бета-разпад на ядрата. По тази причина s-процесът има относително ясна последоватленост: например, стабилни ядра на кадмий-110 са последователно бомбардирани от свободни неутрони в звезда, докато образуват ядра на кадмий-115, които са нестабилни и се разпадат до индий-115 (които са почти стабилни, с период на полуразпад 30 000 пъти възрастта на Вселената). Тези ядра поглъщат неутрони и образуват индий-116, който е нестабилен и се разпада до калай-116 и т.н.[8][11] Обратно, при r-процеса няма такава последователност. s-процесът става невъзможен след бисмута, заради краткият период на полуразпад на следващите два елемента, полоний и астатий, които се разпадат до бисмут или олово. r-процесът е толкова бърз, че може да премине тази зона на нестабилност и да продължи да създава по-тежки елементи, като торий и уран.[12]
Металите кондензират в планети в резултат на процесите на еволюция и разрушение на звездите. Звездите губят много от своята маса при изхвърлянето ѝ в късния етап на техния жизнен цикъл, а понякога и по-късно, в резултат на сливане на неутронни звезди,[13] като по този начин увеличават количеството на елементи, по-тежки от хелия, в междузвездната среда. Когато гравитационното привличане накара тази материя да се уплътни се образуват нови звезди и планети.[14]
Разпространение на Земята
[редактиране | редактиране на кода]
Земната кора е съставена от около 25% (по маса) метали, от които 80% са леки метали, като натрий, магнезий и алуминий. Останалите три четвърти от земната кора са неметали. Въпреки относителната оскъдност на някои по-тежки метали, като медта, в резултат на различни геоложки процеси те могат да се концентрират в количества, които правят възможен стопански ефективният им добив.
Металите в земната кора се срещат главно във вид на литофили или халкофили. Литофилните метали са главно от s-блок и f-блок и по-реактивните елементи от d-блок. Те имат силен афинитет към кислорода и обикновено присъстват като силикатни минерали с относително ниска плътност. Халкофилните метали са главно по-нереактивните елементи от d-блок и металите от 4 до 6 период на p-блок. Те се срещат обикновено в неразтворими сулфидни минерали. Като по-плътни от литофилите, съответно потъващи по-дълбоко в земната кора по време на нейното втвърдяване, халкофилите са по-рядко срещани в повърхностните земни пластове.
В същото време метали като златото са сидерофили. Те не образуват лесно съединения нито с кислорода, нито със сярата. По време на образуването на Земята повечето благородни метали потъват към ядрото, заради склонността си да образуват метални сплави с висока плътност, поради което остават сравнително редки в земната кора. Течното въртящо се външно ядро на Земята, разположено около твърдото вътрешно ядро, е съставено главно от желязо, на което се дължи земното магнитно поле.
Добив
[редактиране | редактиране на кода]Употреба
[редактиране | редактиране на кода]Рециклиране
[редактиране | редактиране на кода]Други
[редактиране | редактиране на кода]На металите е наречена улица в квартал „Факултета“ в София (Карта).
Бележки
[редактиране | редактиране на кода]- ↑ Институт за български език 2020.
- ↑ а б в г д е Mortimer 1975.
- ↑ Yonezawa 2017, с. 257.
- ↑ Martin 2005.
- ↑ Roe 1992, с. 24 – 25, 18 – 19.
- ↑ Holleman 2001.
- ↑ Engineers Edge 2020.
- ↑ а б Cox 1997, с. 73 – 89.
- ↑ Cox 1997, с. 32, 63, 85.
- ↑ Podosek 2011, с. 482.
- ↑ Padmanabhan 2001, с. 234.
- ↑ Hofmann 2002, с. 23 – 24.
- ↑ Hadhazy 2016.
- ↑ Cox 1997, с. 83, 91, 102 – 103.
- Цитирани източници
- Метал // ibl.bas.bg/rbe. Институт за български език, 2020. Посетен на 2020-11-28.
- Cox, PA. The elements: Their origin, abundance and distribution. Oxford, Oxford University Press, 1997. ISBN 978-0-19-855298-7. (на английски)
- Ductility – Strength (Mechanics) of Materials // engineersedge.com. Engineers Edge, 2020. Архивиран от оригинала на 2020-03-08. Посетен на 2020-11-28. (на английски)
- Hadhazy, A. Galactic 'gold mine' explains the origin of nature's heaviest elements // Science Spotlights. kavlifoundation.org, 2016. Архивиран от оригинала на 2016-05-24. Посетен на 2016-07-11. (на английски)
- Hofmann, S. On Beyond Uranium: Journey to the End of the Periodic Table. London, Taylor & Francis, 2002. ISBN 978-0-415-28495-0. (на английски)
- Holleman, A. F. et al. Inorganic Chemistry. San Diego, Academic Press, 2001. ISBN 0-12-352651-5. (на английски)
- Martin, John C. What we learn from a star's metal content // New Analysis RR Lyrae Kinematics in the Solar Neighborhood. 2005. Архивиран от оригинала на 2016-06-29. Посетен на 2005-09-07. (на английски)
- Mortimer, Charles E. Chemistry: A Conceptual Approach. 3rd. New York, D. Van Nostrad Company, 1975. ISBN 9780442255541. (на английски)
- Padmanabhan, Thanu. Theoretical Astrophysics. Vol. 2. Stars and Stellar Systems. Cambridge, Cambridge University Press, 2001. ISBN 978-0-521-56241-6. (на английски)
- Podosek, F. A. Noble gases // Holland, H. D. et al. Isotope Geochemistry: From the Treatise on Geochemistry. Amsterdam, Elsevier, 2011. ISBN 978-0-08-096710-3. p. 467 – 492. (на английски)
- Roe, J et al. World's coinage uses 24 chemical elements // World Coinage News 19 (4, 5). 1992. p. 24 – 25, 18 – 19. (на английски)
- Yonezawa, F. Physics of Metal-Nonmetal Transitions. Amsterdam, IOS Press, 2017. ISBN 978-1-61499-786-3. (на английски)
Вижте също
[редактиране | редактиране на кода]
| ||||||||||||||||||||
|


 French
French Deutsch
Deutsch