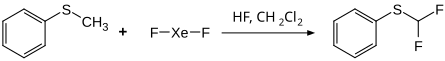Xenondifluorid – Wikipedia
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Xe2+ _ F− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Xenondifluorid | ||||||||||||||||||
| Andere Namen | Xenon(II)-fluorid | ||||||||||||||||||
| Verhältnisformel | XeF2 | ||||||||||||||||||
| Kurzbeschreibung | farblose Kristalle[1] mit penetrantem, ekelerregendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 169,29 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 4,32 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | 128,6 °C[4] | ||||||||||||||||||
| Sublimationspunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | Fluoride 2,5 mg·m−3 einatembarer Staubanteil (als Fluoride gerechnet)[5] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | −164 kJ/mol (Gas)[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Xenon(di)fluorid (XeF2) ist eine farblose, kristalline Edelgasverbindung. Sie wurde 1962 als dritte Verbindung eines Edelgases nach Xenonhexafluoroplatinat (XePtF6)[9] und Xenontetrafluorid (XeF4)[10] erstmals durch Rudolf Hoppe synthetisiert.[11] Unter speziellen Bedingungen reagiert Xenon mit Fluor zu dieser Substanz.
Darstellung
[Bearbeiten | Quelltext bearbeiten]XeF2 lässt sich mithilfe von Katalysatoren wie Fluorwasserstoff oder Nickel(II)-fluorid unter UV-Bestrahlung aus den Elementen darstellen:
Die Reaktion verläuft mit einer molaren Reaktionsenthalpie von −164 kJ·mol−1 exotherm. Sie findet bei 400 °C und 2 bar statt.[12] Die Verbindung lässt sich auch durch die Reaktion von Xenon mit Iodheptafluorid[13] oder durch die Umsetzung von Xenon mit Tetrafluormethan[2] herstellen.
Durch Sublimation lassen sich Kristalle in der Größenordnung von einigen Millimetern gewinnen.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bei Normaldruck und einer Temperatur von 114,35 °C geht es durch Sublimation direkt vom festen in den gasförmigen Zustand über.[3] Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht stehen, liegt bei einer Temperatur von 129,03 °C[3][14] und einem Druck von 1,883 bar.[14] Die Sublimationsdruckfunktion ergibt sich entsprechend ( in Torr, in K) mit , und im Temperaturbereich von 273 bis 388 K.[14] Hier ergibt sich mittels einer Auswertung nach Clausius-Clapeyron eine Sublimationsenthalpie von 55,2 kJ·mol−1.[14] Die kritische Temperatur beträgt 358 °C, der kritische Druck 93,2 bar, die kritische Dichte 1,14 g·cm−3 und das kritische Volumen 149 cm3·mol−1.[15] Kristalle von Xenondifluorid haben eine tetragonale Symmetrie in der Raumgruppe I4/mmm (Raumgruppen-Nr. 139).[16] Das Kristallgitter enthält isolierte XeF2-Moleküle; der Xenon-Fluor-Abstand beträgt 198 pm.[17][13] Bei erhöhten Drücken wurden weitere polymorphe Kristallstrukturen beobachtet. Bei einem Druck von 28 GPa erfolgte eine Umwandlung in ein orthorhombisches Gitter mit der Raumgruppe Immm (Nr. 71), bei 59 GPa ein entsprechendes Gitter mit der Pnma (Nr. 62).[16]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Beim raschen Erhitzen an der Luft zerfällt Xenondifluorid zu Xenon und Fluor. Trotz der negativen Bildungsenthalpie (ΔfH0 = −163 kJ·mol−1) verläuft diese Reaktion explosionsartig, da eine große Volumenzunahme stattfindet. Mit leicht brennbaren Stoffen, wie Aceton, Dimethylsulfid, Aluminiumpulver, Magnesiumpulver sowie auch mit Fetten oder Papier kann die Verbindung explosionsartig reagieren.[18] Mit Wasserstoff setzt sich die Verbindung bei Temperaturen zwischen 300 °C und 400 °C zu Xenon und Fluorwasserstoff um.[6]
Gegenüber starken Lewis-Säuren verhält sich Xenondifluorid in einer Fluoridtransferreaktion als Fluoriddonor. Mit den Pentafluoriden des Arsens, Antimons, Bismuts, Rutheniums, Iridiums und Platins werden je nach Mischungsverhältnis verschiedene ionische Verbindungen gebildet.[6]
- mit M = As, Sb, Bi, Ru, Ir, Pt
Die Verbindung löst sich undissoziiert in Wasser und verfügt hierin über eine Halbwertszeit von 7 Stunden bei 0 °C.[2]
Molekülgeometrie
[Bearbeiten | Quelltext bearbeiten]Gemäß dem VSEPR-Modell besitzt das Xenondifluorid-Molekül eine lineare Struktur mit einem Bindungswinkel (F–Xe–F) von etwa 180°. Im gasförmigen Zustand beträgt die Bindungslänge 197,7 pm.[19]
Xenondifluorid besitzt als Molekülsymmetrie die Punktgruppe D∞h.[19]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Xenon(II)-fluorid wird als starkes Oxidations- und Fluorierungsmittel in der organischen Synthese verwendet.[18] So können über eine Fluordecarboxylierungsreaktion aus aliphatischen Carbonsäuren entsprechende Fluoralkane erhalten werden.[20]
Über eine elektrophile Fluorierung kann eine aromatische C–H-Bindung direkt durch Fluor substituiert werden.[20][21] Die dirigierende Wirkung der Substitution wird entsprechend den Regeln der elektrophile aromatische Substitution bestimmt. So wird beispielsweise Anisol bevorzugt in der ortho- und para-Stellung fluoriert, Nitrobenzol in der meta-Stellung.[20] Methylphenylsulfid ergibt in der Umsetzung mit Xenondifluor ein difluoriertes Produkt.[20]
Mittels Xenondifluorid kann Fluor an Alkene addiert werden.[20] Mit Ethen resultiert ein Produktgemisch aus 45 % 1,2-Difluorethan, 35 % 1,1-Difluorethan und 1,1,2-Trifluorethan.[22] Mit Butadien verläuft die Umsetzung selektiver. Hier resultiert zu 87 % das 1,2-Additionsprodukt. Die Umsetzung mit 2,3-Dimethylbutadien ergibt ausschließlich das 1,2-Difluor-2,3-dimethyl-3-buten.
Die Reaktion mit aromatischen Ketonen und Aldehyden in Gegenwart von katalytischen Mengen von Fluorwasserstoff oder Siliziumtetrafluorid führt zu einer Umlagerung zu difluorsubstituierten Ethern. In Gegenwart von Bortrifluorid wird diese Umlagerung nicht realisiert, wobei dann eine Fluorierung am Aromaten erfolgt.[20][23][24]
Mit Trifluoressigsäure werden die instabilen Ester (CF3COO)2Xe und (CF3COO)XeF gebildet, deren Zersetzung primär zu Trifluormethylradikalen und dann zum Hexafluorethan führt. In Gegenwart von Aromaten oder Heteroaromaten können diese trifluormethyliert werden.[20][25]
Eine Mischung aus Magnesium und Xenon(II)-fluorid ist als hochenergetisches Material interessant und verbrennt mit einer 2575 K heißen Flamme.[26]
Weitere Edelgasverbindungen
[Bearbeiten | Quelltext bearbeiten]Zuweilen konnten noch weitere Xenonverbindungen (v. a. Chloride, Oxide), aber auch die Kryptonverbindung Kryptondifluorid (KrF2) hergestellt werden. Außerdem vermutet man, dass, parallel zu Xenon, auch Radon verschiedene -oxide und -halogenide bilden kann. Die meisten Edelgasverbindungen sind im Vergleich zu XeF2 wesentlich instabiler und häufig hochexplosiv. Die Reaktivität der Edelgase und die Stabilität ihrer Verbindungen nimmt mit steigendem Atomgewicht zu. Radondifluorid ist aber aufgrund der Radioaktivität des Radons instabiler als XeF2 und wurde bisher noch nicht richtig nachgewiesen.[27]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Melita Tramsek, Boris Zemva: Synthesis, Properties and Chemistry of Xenon(II) Fluoride. In: Acta Chim. Slov. Band 53, Nr. 2, 2006, S. 105–116. (PDF)
- Xenon(II) Fluoride. in e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Xenondifluorid bei Merck, abgerufen am 8. Oktober 2010.
- ↑ a b c d James L. Weeks and Max S. Matheson: Xenon difluoride. In: Henry F. Holtzclaw, Jr. (Hrsg.): Inorganic Syntheses. Band 8. McGraw-Hill Book Company, Inc., 1966, S. 260–264 (englisch).
- ↑ a b c d David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-98.
- ↑ D. K. Hindermann, W. E. Falconer: Magnetic Shielding of 19F in XeF2. In: J. Chem. Phys. Band 50, Nr. 3, 1969, S. 1203, doi:10.1063/1.1671178, bibcode:1969JChPh..50.1203H.
- ↑ a b Datenblatt Xenondifluorid bei Alfa Aesar, abgerufen am 8. Oktober 2010 (Seite nicht mehr abrufbar).
- ↑ a b c Ralf Steudel: Chemie der Nichtmetalle, Synthesen – Strukturen – Bindung – Verwendung. 4. Auflage. Walter de Gruyter, Berlin/ Boston 2014, ISBN 978-3-11-030439-8, S. 570, (abgerufen über De Gruyter Online).
- ↑ a b Datenblatt Xenon difluoride bei Sigma-Aldrich, abgerufen am 4. Januar 2018 (PDF).
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. 9. Auflage. Walter de Gruyter GmbH, Berlin 2015, ISBN 978-3-11-035526-0, S. 416.
- ↑ N. Bartlett: Xenon Hexafluoroplatinate(V) Xe+[PtF6]−. In: Proceedings of the Chemical Society. 1962, S. 218; doi:10.1039/PS9620000197.
- ↑ Howard H. Claassen, Henry Selig, John G. Malm: Xenon Tetrafluoride. In: Journal of the American Chemical Society. 84, 1962, S. 3593–3593; doi:10.1021/ja00877a042.
- ↑ Rudolf Hoppe, Wolfgang Dähne, H. Mattauch, K. M. Rödder: Fluorierung von Xenon. In: Angewandte Chemie. 74, 1962, S. 903; doi:10.1002/ange.19620742213.
- ↑ Egon Wiberg, Nils Wiberg, Arnold F. Holleman: Anorganische Chemie. 103. Auflage. Walter de Gruyter, Berlin/ Boston 2017, ISBN 978-3-11-026932-1, S. 464, (abgerufen über De Gruyter Online).
- ↑ a b Eintrag zu Xenon-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2018.
- ↑ a b c d F. Schreiner, G. N. McDonald, C. L. Chernick: Vapor pressure and melting points of xenon difluoride and xenon tetrafluoride. In: J. Phys. Chem. 72, 1968, S. 1162–1166, doi:10.1021/j100850a014.
- ↑ T. Ogrin, B. Zemva, M. Bohinc, J. Slivnik: Critical Constants and Liquid Densities of Xenon Difluoride and Xenon Tetrafluoride. In: J. Chem. Eng. Data 17, 1972, S. 418–419, doi:10.1021/je60055a003.
- ↑ a b Gang Wu, Xiaoli Huang, Yanping Huang, Lingyun Pan, Fangfei Li, Xin Li, Mingkun Liu, Bingbing Liu, Tian Cui: Confirmation of the Structural Phase Transitions in XeF2 under High Pressure. In: J. Phys. Chem. C 121, 2017, S. 6264–6271, doi:10.1021/acs.jpcc.6b11558.
- ↑ Henry A. Lewy, P. A. Agron: The Crystal and Molecular Structure of Xenon Difluoride by Neutron Diffraction. In: Journal of the American Chemical Society. 85, 1963, S. 241–242; doi:10.1021/ja00885a037.
- ↑ a b L. Roth, U. Weller: Gefährliche Chemische Reaktionen. Eintrag für Xenondifluorid, Stand 72. Ergänzungslieferung 3/2014, ecomed Verlag Landsberg/Lech, ISBN 978-3-609-19587-2.
- ↑ a b A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 465 (eingeschränkte Vorschau in der Google-Buchsuche). (abgerufen über De Gruyter Online)
- ↑ a b c d e f g e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Xenon(II)-fluorid, abgerufen am 20. Januar 2018.
- ↑ M. B. Smith, J. March: March's Advanced Organic Chemistry. 5. Auflage. John Wiley Sons, New York 2001, S. 707.
- ↑ N.-C. Yang, T.-C. Shieh, E. D. Feit, C. L. Chernick: Reactions of xenon fluorides with organic compounds. In: J. Org. Chem. 35, 1970, S. 4020–4024, doi:10.1021/jo00837a001.
- ↑ B. Zajc, M. Zupan: Fluorination with xenon difluoride. 37. Room-temperature rearrangement of aryl-substituted ketones to difluoro-substituted ethers. In: J. Org. Chem. 55, 1990, S. 1099–1102, doi:10.1021/jo00290a054.
- ↑ M. Tamura, Y. Matsukawa, H. Quan, J. Mizukado, A. Sakiya: Reaction of carbonyl compounds with xenon difluoride in the presence of silicon tetrafluoride. In: J. Fluor. Chem. 125, 2004, S. 705–709, doi:10.1016/j.jfluchem.2003.11.019.
- ↑ Y. Tanabe, N. Matsuo, N. Ohno: Direct perfluoroalkylation including trifluoromethylation of aromatics with perfluoro carboxylic acids mediated by xenon difluoride. In: J. Org. Chem. 53, 1988, S. 4582–4585, doi:10.1021/jo00254a033.
- ↑ E.-C. Koch, V. Weiser, E. Roth, S. Kelzenberg: Magnesium / Xenon(II) fluoride (MAX) – A New High Energy Density Material. In: 35th International Pyrotechnics Seminar. Fort Collins, USA, Juli 2008, ISBN 978-0-9755274-4-3, S. 695, doi:10.13140/2.1.1718.4961.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. 9. Auflage. Walter de Gruyter GmbH, Berlin 2015, ISBN 978-3-11-035526-0, S. 416–418.


 French
French Deutsch
Deutsch


![{\displaystyle \mathrm {Xe\ +\ F_{2}\ {\xrightarrow[{UV-Licht}]{Kat.}}\ XeF_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4f58691a6fb313994062c56e1c82ad8fcf37ef2)







![{\displaystyle {\ce {2XeF2 + MF5 -> [Xe2F3][MF6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6f432b3cb8f9837487dea8b8ab0e23118d633a8)
![{\displaystyle {\ce {XeF2 + MF5 -> [XeF][MF6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/27800920e775d620063403867d71917006a3a130)
![{\displaystyle {\ce {XeF2 + 2MF5 -> [XeF][M2F11]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6047b925b9cfd022db2481ac84d38827688c623e)