Sulfure de bore — Wikipédia
| Sulfure de bore | |
 | |
| structure cristalline de B2S3 | |
| Identification | |
|---|---|
| Nom UICPA | sulfanylidène(sulfanylidèneboranylsulfanyl)borane[1] |
| Nom systématique | trisulfure de dibore |
| Synonymes | dithioxodiborathiane |
| No CAS | |
| No ECHA | 100.031.355 |
| No CE | 234-504-9 |
| PubChem | 123269 |
| SMILES | |
| InChI | |
| Apparence | solide jaune pâle[2] |
| Propriétés chimiques | |
| Formule | B2S3 [Isomères] |
| Masse molaire[3] | 117,817 ± 0,029 g/mol B 18,35 %, S 81,65 %, |
| Propriétés physiques | |
| T° fusion | 563 °C[4] |
| Masse volumique | 1,7 g·cm-3[4] |
| Cristallographie | |
| Système cristallin | Monoclinique[5] |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | P21/c, n° 14 |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le sulfure de bore est un produit chimique binaire composé de bore et de soufre et de formule brute B2S3. Ce matériau polymérique est d'intérêt en tant que composant de verres "high-tech" et comme réactif pour la préparation de composés organosulfurés. B2S3 est sensible à l'eau, y compris l'humidité atmosphérique et libère du sulfure d'hydrogène, H2S, un composé toxique à son contact. Ainsi ce composé doit être manipulé sous conditions anhydres.
Synthèse
[modifier | modifier le code]Entre autres méthodes, le trisulfure de dibore peut être obtenu par la réaction du borure de fer ou de magnésium et du sulfure d'hydrogène à 300 °C[6] :
- 2 FeB + 4 H2S → B2S3 + FeS + 4 H2
La première synthèse a été réalisée par Jöns Jakob Berzelius en 1824 par réaction directe de bore amorphe avec de la vapeur de soufre[7] :
- 2 B + 3 S → B2S3
Une autre synthèse soutenue par Friedrich Wöhler et Henri Étienne Sainte-Claire Deville a été publiée en 1858. Elle est réalisée à partir de bore et d'hydrogène sulfuré[8],[9] :
- 2 B + 3 H2S → B2S3 + 3 H2
Structure
[modifier | modifier le code]Le sulfure de bore est connu depuis le XIXe siècle comme un solide jaune pâle qui tend à former des phases vitreuses (amorphe). L’absence de cristaux exploitables a cependant retardé la caractérisation de la structure du sulfure de bore jusqu'en 1977. Il a une structure en couche originale totalement différente de la structure tri-dimensionnelle de B2O3 et qui se rapproche plutôt de la structure du nitrure de bore, BN[2]. La structure est du système monoclinique avec le groupe d'espace P21/c (no 14) et avec comme paramètres de maille a = 403,9 ± 0,1 pm, b = 1072,2 ± 0,2 pm, c = 1862,0 ± 0,4 pm et β = 96,23 ± 0,03°, nombre d'unités par maille, Z = 8, volume de la maille, V = 0,801 6 nm3 et une densité calculée, dcalc = 1,952 pour une densité expérimentale, dexp = 1,93 ± 0,03 g/cm3[5]. Cette structure est donc composée de cycles à 6, plans, B3S3 et de cycles à 4, B2S2, liés par des ponts S dans des couches bi-dimensionnelles quasiment planes[5]. Tous les atomes de bore sont sp2 (trigonal plan) avec des distances B-S d'environ 181 pm et la distance perpendiculaire inter-couche vaut à peu près le double, soit 355 pm.
La forme amorphe n'a pas de point de fusion défini et commence à se sublimer aux environs de 300 °C[10].
Utilisation
[modifier | modifier le code]Comme les oxydes de bore, B2S3 forme facilement des verres spéciaux lorsqu'il est mélangé avec d'autres sulfures tels que P4S10. Ces verres absorbent de plus basses fréquences de la bande infrarouge que des verres de borosilicate classiques.
B2S3 est utilisé en synthèse organique. Il réduit des sulfoxydes en thiols et convertit aussi des cétones dans les thiones correspondantes[10]. Par exemple, la conversion de la benzophénone en sa thione procède comme suit :
- B2S3 + 3 (C6H5)2C=O → B2O3 + 3 (C6H5)2C=S
Dans la pratique, B2S3 doit être utilisé en excès[11].
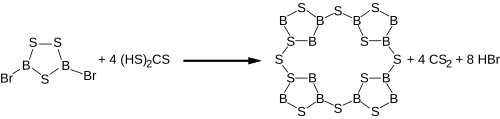
B8S16
[modifier | modifier le code]Un autre sulfure de bore a été découvert en 1980 en chauffant B2S3 et du soufre à 300 °C sous des conditions très strictes[12]. L'analyse du produit incolore et sensible à l'humidité, obtenu donne BS2 comme formule mais une analyse cristallographique par rayon X a révélé que ce composé adopte en fait une structure B8S16 comme une porphyrine. Une méthode alternative pour la synthèse de B8S16 consiste en la réaction du dibromotrithiadiborolane avec l'acide trithiocarbonique comme générateur de H2S dans une solution diluée de CS2[2] :
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Boron sulfide » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Bortrisulfid » (voir la liste des auteurs).
- donné sur PubChem
- N.N. Greenwood, A. Earnshaw, Chemistry of the elements, 1994, 6e Ed., Pergamon Press, p. 421. (ISBN 0-08-022057-6).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- William M. Haynes, CRC Handbook of Chemistry and Physics, 93e Edition, 2012, CRC Press, pp4-53. (ISBN 143988049-2).
- Harald Diercks, Bernt Krebs, Crystal structure of B2S3 : four-membered B2S2 rings and six-menbered B3S3 rings, Angew. Chem. Int. Edn., 1977, vol. 16, p. 313. DOI 10.1002/anie.197703131
- J. Hoffmann, Synthese von Borsulfid aus Ferro- und Manganbor, Zeitschrift für Anorganische Chemie, 1908, vol. 59(1), pp 127–135. DOI 10.1002/zaac.19080590116.
- J. J. Berzelius, Undersökning af flusspatssyran och dess märkvärdigaste föreningar Recherche sur l'acide fluorhydrique et ses composés les plus remarquables, Kongliga Vetenskaps-Academiens Handlingar Actes de l'Académie royale des sciences, 1824, vol. 12, pp 46–98. Réimprimé en allemand sous la ref : J. J. Berzelius, Untersuchungen über die Flußspathsäure und deren merkwürdigsten Verbindungen, Annalen der Physik und Chemie, 1824, vol. 78, pp 113–150. voir spécialement les pages 145–147.
- (de) F. Wöhler, H. E. S.-C. Deville, Neue Beobachtungen über das Bor und einige seiner Verbindungen, Liebigs Annalen der Chemie und Pharmacie, 1858, vol. 105(1), pp 67–73. DOI 10.1002/jlac.18581050109.
- (fr) F. Wöhler, H. E. S.-C. Deville, Du Bore, Annales de Chimie et de Physique, 1858, vol. 52, pp. 62–93.
- Wiley-VCH: Ullmann's Fine Chemicals, John Wiley & Sons, 2013, p. 351. (ISBN 978352768357-4).
- R. Sato, Boron Trisulfide in L. Paquette, Encyclopedia of Reagents for Organic Synthesis, 2004, J. Wiley & Sons, New York. doi:10.1002/047084289X.rb255.
- B. Krebs, H.-U. Hürter, B8S16 - An "inorganic porphirine", Angew. Chem. Int. Edn., 1980, vol. 18, pp 481-482.


 French
French Deutsch
Deutsch