Bromure de césium — Wikipédia
| Bromure de césium | |
 | |
| __ Cs+ __ Br− | |
| Identification | |
|---|---|
| DCI | Bromure de césium |
| Synonymes | Bromure de césium(I) |
| No CAS | |
| No ECHA | 100.029.209 |
| No CE | 232-1300 |
| PubChem | 24592 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs ou inolores |
| Propriétés chimiques | |
| Formule | CsBr |
| Masse molaire[2] | 212,809 ± 0,001 g/mol Br 37,55 %, Cs 62,45 %, |
| Susceptibilité magnétique | −67,2×10−6 cm3·mol-1[1] |
| Propriétés physiques | |
| T° fusion | 636 °C[3] |
| T° ébullition | 1 300 °C[3] |
| Solubilité | 1 230 g·L-1 (eau, 25 °C)[3] |
| Masse volumique | 4,43 g·cm-3[3] |
| Thermochimie | |
| ΔfH0solide | −406 kJ·mol-1[4] |
| Cristallographie | |
| Système cristallin | cubique |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | Pm3m (no 221) [5] |
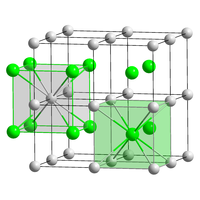
| Structure type | CsCl |
| Paramètres de maille | a= 0,429 1 nm |
| Volume | 0,079 0 nm3 |
| Propriétés optiques | |
| Indice de réfraction | 1,8047 (0,3 µm) 1,6974 (0,59 µm) 1,6861 (0,75 µm) 1,6784 (1 µm) 1,6678 (5 µm) 1,6439 (20 µm)[6] |
| Précautions | |
| SGH | |
| H302, H315, H319, H335, P261, P264, P270, P271, P280, P312, P321, P330, P362, P301+P312, P302+P352, P304+P340, P305+P351+P338, P332+P313, P337+P313, P405, P403+P233 et P501 | |
| Écotoxicologie | |
| DL50 | 1400 mg/kg (oral, rat)[7] |
| Composés apparentés | |
| Autres cations | Bromure de sodium Bromure de potassium Bromure de rubidium Bromure de francium |
| Autres anions | Fluorure de césium Chlorure de césium Iodure de césium Astature de césium |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le bromure de césium est un composé ionique du césium et du brome de formule chimique CsBr. C'est un solide blanc ou transparent avec un point de fusion de 636 °C qui se dissout facilement dans l'eau. Ses cristaux massifs possèdent le même type de structure cubique que le chlorure de césium, mais prennent une structure de type cubique à faces centrées similaire à celle du chlorure de sodium dans les films nanométriques formés sur des substrats de mica, LiF, KBr ou NaCl[8].
Synthèse
[modifier | modifier le code]Le bromure de césium peut être préparé par les réactions suivantes :
- CsOH (aq) + HBr (aq) → CsBr (aq) + H2O (l)
- Cs2(CO3) (aq) + 2 HBr (aq) → 2 CsBr (aq) + H2O (l) + CO2 (g)
- Synthèse directe :
- 2 Cs (s) + Br2 (g) → 2 CsBr (s)
La synthèse directe est une réaction violente du césium avec les autres halogènes. À cause de son coût élevé, elle n'est pas utilisée en préparation.
Utilisations
[modifier | modifier le code]Le bromure de césium est parfois utilisé en optique comme miroir semi-réfléchissant dans les spectrophotomètres à large bande.
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Caesium bromide » (voir la liste des auteurs).
- Haynes, p. 4.132
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Haynes, p. 4.57
- (de) A.F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlin, de Gruyter, , 102e éd., 2149 p. (ISBN 978-3-11-017770-1), p. 1281
- J. Vallin, O. Beckman et K. Salama, « Elastic Constants of CsBr and CsI from 4.2°K to Room Temperature », Journal of Applied Physics, vol. 35, no 4, , p. 1222 (DOI 10.1063/1.1713597)
- Haynes, p. 10.240
- Caesium bromide. nlm.nih.gov
- L. G. Schulz, « Polymorphism of cesium and thallium halides », Acta Crystallographica, vol. 4, no 6, , p. 487 (DOI 10.1107/S0365110X51001641)
Liens externes
[modifier | modifier le code]- MSDS at Oxford University
- Physical data, [ Crystran PDF version]« http://www.crystran.co.uk/getfile.php?file=104 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), , PDF version
- IR transmission spectrum
- Ultra-violet photoabsorption measurements in alkali iodide and caesium bromide evaporated films


 French
French Deutsch
Deutsch



