Chlorure d'erbium(III) — Wikipédia
Le chlorure d'erbium(III) est un composé inorganique, un chlorure du lanthanide erbium.
Propriétés
[modifier | modifier le code]
Le chlorure d'erbium anhydre est solide violet, mais sa forme hexahydratée, bien plus courante, est un solide rose. Cette couleur rose est d'ailleurs bien plus intense sous lampe fluorescente.
Les solutions de chlorure d'erbium présentent un effet d'absorption non-linéaire négative[7].
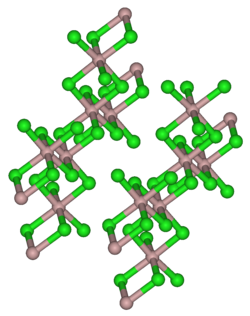
La forme anhydre du chlorure d'erbium cristallise dans une forme monoclinique de groupe d'espace C2/m similaire à celle du chlorure d'aluminium(III)[8].
La forme hexahydratée possède elle aussi une structure monoclinique, mais de groupe d'espace P2/n (P2/c) - C42h. L'erbium est alors octa-coordonné pour former l'ion [Er(H2O)6Cl2]+ avec le Cl− isolé[9].
Synthèse
[modifier | modifier le code]Le chlorure d'erbium(III) peut être formé par réaction entre l'oxyde d'erbium(III) avec le chlorure d'ammonium[10] :
- Er2O3 + 3 NH4Cl → ErCl3 + 3 NH3 + 3 H2O
Cette réaction fonctionne aussi à partir carbonate d'erbium(III)[10] :
- Er2(CO3)3 + 6 NH4Cl → 2 ErCl3 + 6 NH3 + 3 CO2 + 3 H2O
Dans les deux cas, le chlorure d'ammonium est utilisé en large excès, formant le sel intermédiaire (NH4)3ErCl6. Ce sel est stable vis-à-vis de l'hydrolyse et peut ensuite être décomposé thermiquement sous vide pour former le chlorure d'erbium(III) anhydre, avec dégagement d'ammoniac et de chlorure d'hydrogène.
La forme hexahydratée peut être obtenue par réaction entre l'erbium métallique et l'acide chlorhydrique :
- Er + 6 HCl → 2 ErCl3 + 3 H2
En utilisant le chlorure de thionyle à la place de ce dernier, il est possible d'obtenir la forme anhydre[10].
Il est encore possible d'obtenir le chlorure d'erbium(III) directement à partir de l'erbium métallique et du dichlore[11] :
- 2 Er + 3Cl2 → 2 ErCl3
Il est enfin possible de ré-obtenir la forme en chauffant le forme hexahydratée dans une atmosphère fortement chlorée, par exemple dans le dichlore ou le chlorure d'hydrogène, sinon c'est l'oxychlorure d'erbium (ErOCl) qui est formé.
Réactivité
[modifier | modifier le code]Le chlorure d'erbium(III) réagit avec les bases alcalines pour former l'hydroxyde d'erbium(III) :
- ErCl3 + 3 XOH → Er(OH)3 + 3 XCl
Utilisation
[modifier | modifier le code]Le chlorure d'erbium(III) peut être utilisé dans la production d'erbium pur[12].
C'est un puissant catalyseur dans les réactions d'acylation des alcools et phénols et peut être facilement recyclé et réutilisé sans perte d'activité significative[13]
Notes et références
[modifier | modifier le code]- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Erbium(III) chloride » (voir la liste des auteurs) et en allemand « Erbium(III)-chlorid » (voir la liste des auteurs).
- « Fiche du composé Erbium chloride, anhydrous », sur Alfa Aesar (consulté le ).
- Fiche Sigma-Aldrich du composé Erbium(III) chloride, consultée le 19 mars 2015.
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Jean D'Ans, Ellen Lax, Taschenbuch für Chemiker und Physiker, , 1463 p. (ISBN 978-3-540-60035-0), p. 444
- Archives of Environmental Health. Vol. 5, Pg. 437, 1962. Pubmed
- ↑ Environmental Quality and Safety, Supplement. Vol. 1, Pg. 1, 1975. Pubmed
- ↑ Maeda Y., Akidzuki Y., Yamada T., « All-optical liquid device derived from negative nonlinear absorption effect in an erbium chloride solution », Applied Physics Letters, vol. 73, no 17, , p. 2411–2413 (DOI 10.1063/1.122450)
- ↑ Tempelton DH, Carter GF, « The Crystal Structure of Yttrium Trichloride and Similar Compounds », J Phys Chem, vol. 58, no 11, , p. 940–943 (DOI 10.1021/j150521a002)
- ↑ (en) Graebner EJ, Conrad GH Duliere SF, « Crystallographic data for solvated rare earth chlorides », Crystallographic data for solvated rare earth chlorides, vol. 21, , p. 1021
- Georg Brauer: Handbuch der Präparativen Anorganischen Chemie, Band 2, (ISBN 3-432-87813-3), S. 897.
- ↑ Webelements: Erbium
- ↑ John Emsley, Nature's building blocks : an A-Z guide to the elements, Oxford University Press, , 538 p. (ISBN 978-0-19-850340-8, lire en ligne), p. 137
- ↑ Renato Dalpozzo, Antonio De Nino, Loredana Maiuolo, Manuela Oliverio, Antonio Procopio, Beatrice Russo, Amedeo Tocci: Erbium(III) Chloride: a Very Active Acylation Catalyst, Australian Journal of Chemistry, 2006, 60(1), S. 75–79, DOI 10.1071/CH06346, lien.


 French
French Deutsch
Deutsch