Bilirubina – Wikipedia, wolna encyklopedia
| |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C33H36N4O6 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 584,66 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | czerwony proszek[1] | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | 635-65-4 | ||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
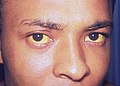
Bilirubina (z łac. bilis – żółć, ruber – czerwony) – pomarańczowoczerwony barwnik żółciowy ssaków, produkt rozpadu hemu hemoglobiny i innych hemoprotein. Wzrost stężenia bilirubiny we krwi i tkankach może powodować zażółcenie skóry i białkówki oczu, czyli żółtaczkę. Barwnik ten wykryty został także u roślin z rodzaju strelicja.
Przemiany i znaczenie bilirubiny
[edytuj | edytuj kod]U ssaków, w tym u człowieka, bilirubina powstaje wskutek degradacji części porfirynowej hemu, po uprzednim wyłączeniu i zmagazynowaniu jonu żelaza. Degradacja hemu prowadzi do powstania zielonkawej biliwerdyny, która następnie ulega redukcji do bilirubiny przy udziale enzymu – reduktazy biliwerdynowej – i NADPH (dawcy protonu)[4][5]:
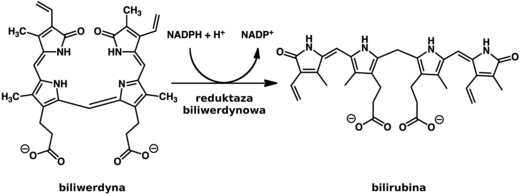
U płazów, gadów i ptaków dobrze rozpuszczalna w wodzie biliwerdyna jest najczęściej ostatecznym produktem degradacji hemoporfiryn i to biliwerdyna jest wydalana z organizmu. U ssaków bilirubina jest jednym z głównych antyoksydantów obecnym w osoczu krwi i w błonach komórkowych[5].
Bilirubina jest związkiem słabo rozpuszczalnym w wodzie, stąd w osoczu krwi transportowana jest w połączeniu z białkiem – albuminą. Frakcja bilirubiny nietrwale związanej z albuminami nazywana jest bilirubiną wolną lub pośrednią. Bilirubina wolna nie przedostaje się do moczu, może jednak przenikać barierę krew-mózg[4] i łożysko u ciężarnych[6].
Bilirubina wolna transportowana jest do wątroby, gdzie ulega dalszym przemianom do rozpuszczalnej w wodzie bilirubiny związanej (bezpośredniej), przez co traci zdolność przenikania bariery krew-mózg i łożyska. UDP-glukuronozylotransferaza sprzęga bilirubinę z kwasem glukuronowym (glukuronianem) w dwóch następujących po sobie reakcjach tworząc odpowiednio mono- i diglukuronid bilirubiny:
gdzie UDP-GT – UDP-glukuronozylotransferaza[4][5][6].
Bilirubina związana wydzielana jest aktywnie do żółci, skąd dalej trafia do jelita[7]. Jest tam przekształcana w barwniki żółciowe – urobilinogeny (sterkobilinogeny) przy udziale enzymów bakteryjnych[4][5].
Szacuje się, że z 1 grama hemoglobiny powstaje 35 mg bilirubiny[4]. 70–90% bilirubiny pochodzi z hemoglobiny starych erytrocytów niszczonych w układzie siateczkowo-śródbłonkowym. Pozostała część związana jest z nieefektywną erytropoezą w szpiku kostnym oraz degradacją pozostałych hemoprotein (mioglobina, cytochrom P450 i inne)[4][8][9][7]. Dzienne wytwarzanie bilirubiny przez dorosłego człowieka wynosi ok. 200–350 mg[4][7], u noworodków jest nawet 3-krotnie większe[6].
Wpływ światła na bilirubinę
[edytuj | edytuj kod]Bilirubina jest związkiem wrażliwym na działanie światła naturalnego i sztucznego. W czasie ekspozycji na światło dochodzi do jej izomeryzacji geometrycznej i utleniania[6][10]. Reakcje te zależą od temperatury i zachodzą szybciej w 20–25 °C, niż w 4 °C[11].
Fotowrażliwość bilirubiny znalazła zastosowanie w leczeniu żółtaczek poprzez fototerapię, gdyż in vivo fotoizomery są łatwo usuwane z wątroby do żółci, z pominięciem reakcji sprzęgania z glukuronianem[10]. W fototerapii noworodków donoszonych stosuje się światło niebieskie i białe, gdy stężenie bilirubiny wolnej wynosi 16–18 mg/dl (273,6 – 307,8 μmol/l)[6].
W diagnostyce laboratoryjnej ekspozycja na światło może wpłynąć na wynik oznaczania bilirubiny, zaniżając jej stężenie, jeśli próbka nie była chroniona przed światłem[8][11].
Wpływ leków na metabolizm bilirubiny[7]
[edytuj | edytuj kod]Substancje pobudzające UDP-glukuronozylotransferazę zwiększają wydzielanie z żółcią glukuronidów bilirubiny i zmniejszają tym samym jej stężenie we krwi. Działanie takie wykazuje fenobarbital, stosowany z zapobieganiu i leczeniu żółtaczki noworodków. Istnieją również leki, które silnie hamują wymieniony enzym, zwiększając ryzyko żółtaczki, np. nowobiocyna. Interakcja może również zachodzić na poziomie wiązania z albuminami, m.in. niesteroidowe leki przeciwzapalne mające silniejsze powinowactwo do białek osocza niż bilirubina powodują zwiększenie jej stężenia we krwi.
Chlorpromazyna oraz związki o działaniu anabolicznym i androgennym zaburzają procesy transportu glukuronidów bilirubiny w wątrobie, prowadząc do powstania żółtaczki zastoinowej.
Bilirubina jako marker w diagnostyce laboratoryjnej
[edytuj | edytuj kod]Bilirubina wykrywana jest we krwi zdrowych ludzi, u których całkowite stężenie w surowicy nie przekracza najczęściej 1[8] – 1,3[9] mg/dl (17,1 – 22,2 μmol/l). Stężenie to jest fizjologicznie wyższe u dzieci do 1 miesiąca życia, zwłaszcza u wcześniaków. U tych ostatnich prawidłowe stężenie może sięgać nawet do 16 mg/dl (273,6 μmol/l) w 3-5 dniu życia[8]. Dokładne wartości referencyjne ustala laboratorium w zależności m.in. od stosowanej metodologii oraz wieku pacjenta.
Podwyższone stężenie bilirubiny określa się jako hiperbilirubinemię. U chorych bilirubina sprzężona może przenikać do moczu. Taki stan nazywa się cholurią[4].
Przyczyny hiperbilirubinemii
[edytuj | edytuj kod]Hiperbilirubinemia może być spowodowana zwiększonym wytwarzaniem bilirubiny (hiperbilirubinemia przedwątrobowa), zmniejszoną zdolnością do jej wychwytu i sprzęgania z glukuronianem (hiperbilirubienemia wątrobowa) lub też niezdolnością wydzielania bilirubiny do żółci (hiperbilirubiemia zastoinowa). Hiperbilirubinemię przedwątrobową cechuje obecność głównie bilirubiny wolnej, zaś zastoinową dominacja bilirubiny sprzężonej. W różnych patologiach wątroby stosunek między frakcjami wolną i sprzężoną jest różny i zależy od przyczyny choroby[9].
| Wybrane przyczyny hiperbilirubinemii[12] | ||
| dominacja frakcji wolnej | dominacja frakcji sprzężonej | |
| fizjologiczne | ||
| patologiczne |
|
|
Metody oznaczania bilirubiny[14]
[edytuj | edytuj kod]Poziom bilirubiny można mierzyć oznaczając jej zawartość bezpośrednio we krwi lub z użyciem nieinwazyjnego, przezskórnego bilirubinometru.
Materiałem do badań laboratoryjnych jest surowica lub osocze krwi. Na analizatorach biochemicznych można oznaczać bezpośrednio bilirubinę całkowitą, bilirubinę wolną i bilirubinę sprzężoną.
Hijmans van den Bergh (1916) opracował reakcję z odczynnikiem dwuazowym Ehrlicha, która pozwoliła określić kolorymetrycznie stężenie bilirubiny sprzężonej (reagującej bezpośrednio) oraz całkowitej (po dodaniu metanolu jako rozpuszczalnika dla bilirubiny wolnej). Frakcję pośrednią (wolną) wyliczano z różnicy bilirubiny całkowitej i bezpośredniej. Modyfikacje tej metody to reakcja Evelyn-Malloy (1937) oraz reakcja Jendrassik-Grof (1938). W tej ostatniej zamiast alkoholu zastosowano kofeinę i benzoesan sodu, w obecności których bilirubina dysocjuje od albumin[15].
Aby bezpośrednio oznaczyć frakcje wolną i sprzężoną bilirubiny, wykorzystuje się zmodyfikowaną metodę Jendrassik-Grof, dokonując dwukrotnie pomiaru kolorometrycznego przy dwóch długościach fali (400 i 460 nm). Pierwszy pomiar pozwala określić stężenie bilirubiny całkowitej, drugi zaś wykorzystuje różnicę w molowej zdolności absorpcyjnej frakcji wolnej i sprzężonej[16].
Wysokosprawna chromatografia cieczowa (HPLC) pozwala rozdzielić bilirubinę na 4 frakcje:
- alfa – frakcja bilirubiny wolnej
- beta – frakcja bilirubiny sprzężonej (monoglukuronid bilirubiny)
- gamma – frakcja bilirubiny sprzężonej (diglukuronid bilirubiny)
- delta – frakcja bilirubiny sprzężonej, związanej kowalencyjnie z albuminami; nie występuje u osób zdrowych i pojawia się przy wysokich, utrzymujących się stężeniach bilirubiny sprzężonej; utrzymuje się we krwi ok. 2 tygodni
Metoda HPLC nie ma szerokiego zastosowania w rutynowej diagnostyce.
W niektórych analizatorach gazometrycznych istnieje możliwość oznaczania stężenia bilirubiny całkowitej. Materiałem do tych badań jest krew pełna, a pomiar dokonywany jest fotometrycznie przy kilku długościach fali[17].
W trakcie badania ogólnego moczu testuje się mocz na obecność bilirubiny oraz urobilinogenu. Bilirubina może krystalizować w moczu o kwaśnym pH, zwłaszcza po schłodzeniu, a jej kryształy są widoczne podczas analizy osadu moczu najczęściej w postaci żółto-brązowych igieł[11].
Jednostki stężenia bilirubiny
[edytuj | edytuj kod]Stężenie bilirubiny i jej frakcji wyraża się w jednostkach konwencjonalnych (mg/dl) lub w jednostkach SI (μmol/l)[9]:
1 mg/dl = 10 mg/l = 17,1 μmol/l.
Rola bilirubiny w powstawaniu żółtaczek
[edytuj | edytuj kod]Obecność bilirubiny w skórze powoduje jej charakterystyczne zażółcenie i towarzyszy np. wchłanianiu siniaka[4][5].
Żółtaczką nazywa się zażółcenie rozległych obszarów skóry, błon śluzowych i twardówek oczu. Dochodzi do niej, gdy stężenie bilirubiny całkowitej we krwi przekroczy 2 mg/dl[9]–2,5 mg/dl[8] (34,2 – 42,8 μmol/l), jednak nie ma korelacji między intensywnością zażółcenia skóry a stężeniem bilirubiny we krwi[17]. Ponadto, u niemowląt wystąpienie klinicznej żółtaczki związane jest często z wyższym niż u dorosłych stężeniem bilirubiny (5–9 mg/dl, co odpowiada 85,5–153,9 μmol/l)[17][6].
Wysokie stężenie bilirubiny wolnej, rzędu 20–25 mg/dl (342,0–427,5 μmol/l), może powodować żółtaczkę jąder podkorowych mózgu (łac. kernicterus) i jego toksyczne uszkodzenie[4].
- Żółto zabarwiony krwiak
- Frędzlowata osnówka strelicji zabarwiona biblirubiną
Rola bilirubiny w powstawaniu kamieni żółciowych
[edytuj | edytuj kod]Bilirubina wchodzi w skład kamieni żółciowych barwnikowych. Może dochodzić do wzrostu stężenia bilirubiny pośredniej w żółci wskutek zwiększonej produkcji przez wątrobę lub dekoniugacji pod wpływem bakteryjnej β-glukuronidazy w przebiegu przewlekłych zakażeń bakteryjnych dróg żółciowych[18].
Bilirubina u roślin
[edytuj | edytuj kod]We wrześniowym (2010) numerze HortScience ogłoszono wykrycie bilirubiny w osnówkach nasion strelicji królewskiej oraz Strelitzia nicolai, których jest głównym barwnikiem, a także w niewielkich ilościach w okwiecie tych gatunków[19][20].
Przypisy
[edytuj | edytuj kod]- ↑ SABilirubin (nr B4126) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑ CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 3-46, ISBN 978-0-8493-0488-0 (ang.).
- ↑ Bilirubin, [w:] PubChem [online], United States National Library of Medicine, CID: 5280352 (ang.).
- ↑ a b c d e f g h i j Robert K. Murray, Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell: Biochemia Harpera. Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 452–460. ISBN 83-200-2898-1.
- ↑ a b c d e Lubert Stryer: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2003, s. 784-785. ISBN 83-01-13978-1.
- ↑ a b c d e f Karen J. Marcdante, Robert M. Kliegman, Hal B. Jenson, Richard E. Behrman: Nelson pediatria. Tom 1. Wrocław: Elsevier Urban & Partner, 2012, s. 259–262. ISBN 978-83-7609-515-8.
- ↑ a b c d Wojciech Kostowski, Zbigniew S. Herman: Farmakologia – podstawy farmakoterapii: podręcznik dla studentów medycyny i lekarzy. Wyd. 3 poprawione i uzupełnione. Warszawa: Wydawnictwo Lekarskie PZWL, 2006, s. 1569. ISBN 83-200-3352-7.
- ↑ a b c d e f Jacques B. Wallach: Interpretacja badań laboratoryjnych. Warszawa: MediPage, 2011, s. 44–45, 264–266. ISBN 978-83-61104-38-4.
- ↑ a b c d e Diagnostyka laboratoryjna z elementami biochemii klinicznej. Aldona Dembińska-Kieć, Jerzy W. Naskalski (red.). Wrocław: Urban & Partner, 2005 (dodruk), s. 654–659. ISBN 83-87944-33-5.
- ↑ a b P.T. Pisciotto: New Treatment Options in Neonatal Hyperbilirubinaemia. W: Neonatology and Blood Transfusion. C. TH. Smit Sibinga, N. Luban (red.). Boston, MA: Springer US, 2005, s. 115–128. ISBN 978-0-387-23600-1. (ang.).
- ↑ a b c Nancy A. Brunzel: Diagnostyka laboratoryjna. Nerka i badania laboratoryjne moczu. T. I. Wrocław: Elsevier Urban & Partner, 2010, s. 160–164. ISBN 978-83-7609-264-5.
- ↑ Robbins. Patologia. Vinay Kumar, Ramzi S. Cotran, Stanley L. Robbins (red.). Wyd. 1. Wrocław: Elsevier Urban & Partner, 2007, s. 680–683. ISBN 83-89581-92-2.
- ↑ Sabina Więcek, Halina Woś, Urszula Grzybowska-Chlebowczyk. Hiperbilirubinemie czynnościowe u dzieci. „Pediatria Współczesna. Gastroenterologia, Hepatologia i Żywienie Dziecka”, 2011. Cornetis. ISSN 1507-5532.
- ↑ Phillip R. Bach: Bilirubin testing: traditional and more. Children’s Health Improvement through Laboratory Diagnostics, Department of Pathology, University of Utah. [dostęp 2012-12-05]. (ang.).
- ↑ B.C. Shull, H. Lees, P.K. Li, Mechanism of interference by hemoglobin in the determination of total bilirubin. I. Method of Malloy-Evelyn, „Clinical Chemistry”, 26 (1), 1980, s. 22–25, PMID: 7356566.
- ↑ T.W. Wu i inni, The Ektachem clinical chemistry slide for simultaneous determination of unconjugated and sugar-conjugated bilirubin, „Clinical Chemistry”, 30 (8), 1984, s. 1304–1309, PMID: 6744576.
- ↑ a b c D. Watson, J.A. Rogers, A study of six representative methods of plasma bilirubin analysis, „Journal of Clinical Pathology”, 14, 1961, s. 271–278, DOI: 10.1136/jcp.14.3.271, PMID: 13783422, PMCID: PMC480210.
- ↑ Gastroenterologia. Cz. 1 Wielka Interna. Warszawa: Medical Tribune Polska, 2012, s. 395. ISBN 978-83-60135-99-0.
- ↑ First discovery of bilirubin in a flower announced. [w:] Phys.org [on-line]. [dostęp 2012-12-05]. (ang.).
- ↑ Cary Pirone i inni, The Animal Pigment Bilirubin Identified in Strelitzia reginae, the Bird of Paradise Flower, „Hortscience”, 45 (9), 2010, s. 1411–1415 [dostęp 2019-01-02].


 French
French Deutsch
Deutsch