Difosfina – Wikipedia, wolna encyklopedia
| |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny | P | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | H | ||||||||||||||
| Masa molowa | 65,98 g/mol | ||||||||||||||
| Wygląd | bezbarwna ciecz[2] | ||||||||||||||
| Identyfikacja | |||||||||||||||
| Numer CAS | |||||||||||||||
| PubChem | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | |||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||
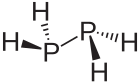
Difosfina, P
2H
4 – nietrwały nieorganiczny związek chemiczny, połączenie fosforu i wodoru o budowie chemicznej analogicznej do hydrazyny (H
2N−NH
2). Jest bezbarwną cieczą ulegającą spontanicznemu zapłonowi w powietrzu. Zawartość difosfiny w fosfinie jest przyczyną jej samozapłonu w powietrzu o temperaturze pokojowej. Difosfina posiada charakterystyczny zapach zgniłych ryb – wyczuwalny nawet przy bardzo niskich stężeniach.
Difosfinę otrzymać można przez hydrolizę fosforku wapnia (Ca
3P
2) w obniżonej temperaturze i oddzielenie od fosforiaku[3][4]. Powstaje jako produkt uboczny w procesie otrzymywania fosfiny[5]. Może powstawać także podczas rozkładu materii organicznej i według niektórych hipotez, difosfina powstająca w ten sposób przyczynia się do występowania błędnych ogników[6].
Właściwości chemiczne
[edytuj | edytuj kod]Difosfina jest nietrwałym związkiem będącym silnym reduktorem, ulega samozapłonowi na powietrzu[5]. Pod wpływem światła[3][7] lub działania chlorowodoru w −125 °C[7] dysproporcjonuje na fosfinę i fosfor czerwony:
- 6P
2H
4 → 8PH
3 + P
4
Podczas ogrzewania difosfina ulega termolizie z wytworzeniem fosfin cyklicznych P
nH_{n} (n = 3–10) i policyklicznych P
nH_{m} (m < n), wśród których przeważa pentafosfolan (PH)
5 i związki policykliczne zawierające pierścienie pięcioczłonowe[4].
W reakcji z butylolitem w −25 °C następuje dysproporcjonowanie do fosforiaku i policyklicznego heptafosforku trilitu Li
3P
7[4] o szkielecie heptafosfanortricyklenu[a].
Pochodne organiczne
[edytuj | edytuj kod]Difosfinami nazywane są związki fosforoorganiczne o budowie R
2P−PR
2 (np. tetrametylodifosfina Me
2P−PMe
2) oraz R
2P−(CH
2)
n−PR
2 (wykorzystywane jako ligandy dwukleszczowe, np. 1,1-bis(difenylofosfino)metan, Ph
2P−CH
2−PPh
2).
Uwagi
[edytuj | edytuj kod]- ↑ Zobacz strukturę: Li3P7, [w:] PubChem [online], United States National Library of Medicine, CID: 12761234 [dostęp 2016-01-04] (ang.).
Przypisy
[edytuj | edytuj kod]- ↑ Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 325, ISBN 978-0-85404-438-2 (ang.).
- ↑ a b c d e CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, s. 4-80, 16-18, ISBN 978-1-4822-0867-2 (ang.).
- ↑ a b Stanisław Tołłoczko, Wiktor Kemula, Chemia nieorganiczna z zasadami chemii ogólnej, Warszawa: Państwowe Wydawnictwo Naukowe, 1954, s. 320.
- ↑ a b c Marianne Baudler, Klaus Glinka, Monocyclic and polycyclic phosphines, „Chemical Reviews”, 93, 1993, s. 1623–1667, DOI: 10.1021/cr00020a010 (ang.).
- ↑ a b Adam Bielański, Podstawy chemii nieorganicznej, wyd. 6, t. 1–2, Warszawa: Wydawnictwo Naukowe PWN, 2010, s. 679–680, ISBN 978-83-01-16283-2.
- ↑ Józef Żychowski, Conditions Favoring the Occurrence of Ignis Fatuus Phenomenon Over a Mass Grave in Niepołomice (S Poland), „Procedia – Social and Behavioral Sciences”, 120, 2014, s. 347–355, DOI: 10.1016/j.sbspro.2014.02.112 (ang.).
- ↑ a b Philip John Durrant, Bryl Durrant, Zarys współczesnej chemii nieorganicznej, Warszawa: Państwowe Wydawnictwo Naukowe, 1965, s. 811.


 French
French Deutsch
Deutsch