Monossacarídeo – Wikipédia, a enciclopédia livre
Monossacarídeos são carboidratos não polimerizados, por isso, não sofrem hidrólise. Possuem em geral entre três e sete átomos de carbono. O termo inclui aldoses, cetoses, e vários derivados, por oxidação, desoxigenação, introdução de outros grupos substituintes, alquilação ou acilação das hidroxilas e ramificações[1].
Quanto aos grupamentos funcionais
[editar | editar código-fonte]- Aldoses: Monossacarídeos de função mista poliálcool-aldeido, como a glicose , galactose, arabinose e manose:

Quanto ao número de átomos de carbono
[editar | editar código-fonte]- Trioses: Monossacarídeos com 3 átomos de carbono:
- Tetroses: Monossacarídeos com 4 átomos de carbono:

Eritrose - Pentoses: Monossacarídeos com 5 átomos de carbono:

Ribose - Hexoses: Monossacarídeos com 6 átomos de carbono:

Galactose - Heptoses: Monossacarídeos com 7 átomos de carbono
Ciclização
[editar | editar código-fonte]Furano e pirano
[editar | editar código-fonte]Quando monossacarídeos se ciclizam sob a forma do anel "pirano" são conhecidos como piranosídicos e o nome do monossacarídeo é acompanhado pelo sufixo piranose, a fim de designar sua correta conformação espacial. Por exemplo, a glucose piranosídica é conhecida como glucopiranose. A mesma conjugação de substantivos também é válida para os monossacarídeos que se ciclizam na forma do anel furanosídico (nome oriundo da molécula furano). A frutose, por exemplo, se ciclizada dessa forma, é conhecida como frutofuranose.
Ciclização de hexoses
[editar | editar código-fonte]Em solução aquosa, as hexoses sofrem uma interação intramolecular formando uma estrutura cíclica, na forma de pentanel ( furano ) ou na forma de hexanel ( pirano ).
- Quando a interação ocorre entre os carbonos 1 e 4 forma-se a α-glicose furanósica ( os grupos OH dos carbonos 1 e 2 estão em posição cis) ou a forma β-glicose furanósica ( os grupos OH do carbono 1 e 2 estão em posição trans):

⇐>

⇐>

- Quando a interação ocorre entre os carbonos 1 e 5 forma-se a α-glicose piranósica ( os grupos OH do carbono 1 e 2 estão em posição cis) ou a forma β-glicose piranósica ( os grupos OH dos carbonos 1 e 2 estão em posição trans):

⇒

⇐>
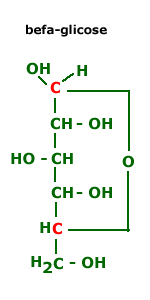
Isomeria espacial
[editar | editar código-fonte]- Isomeria óptica: A existência de carbonos assimétricos confere aos monossacarídeos a propriedade de girar as ondas unidirecionais da luz polarizada possuindo, portanto, estruturas destrógiras ( D ) e levógiras ( L ).
- Isomeria geométrica: Devido a interação intramolecular, as hidroxilas dos carbonos 1 e 2 dos monossacarídeos podem orientar-se espacialmente na configuração cis ( α ) ou trans ( β).
Referências
- ↑ Victor Gold, IUPAC Gold Book, monosaccharides


 French
French Deutsch
Deutsch




