Actiniu
| Actiniu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații generale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nume, Simbol, Număr | Actiniu, Ac, 89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie chimică | Actinide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupă, Perioadă, Bloc | 3, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 10.070 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Culoare | argintie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr CAS | 7440-34-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă atomică | 227 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază atomică | 195 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurație electronică | Rn6d17s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electroni pe nivelul de energie | 2, 8, 18, 32, 18, 9, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr de oxidare | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid | Ac2O3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structură cristalină | cubică cu fețe centrate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fază ordinară | solidă | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de topire | 1050 °C 1323 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 3300°C 3471 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presiune de vapori | 400 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații diverse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitate (Pauling) | 1,1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 12 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prima energie de ionizare | 499 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 2-a energie de ionizare | 1170 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 3-a energie de ionizare | {{{potențial_de_ionizare_3}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 4-a energie de ionizare | {{{potențial_de_ionizare_4}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 5-a energie de ionizare | {{{potențial_de_ionizare_5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 6-a energie de ionizare | {{{potențial_de_ionizare_6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 7-a energie de ionizare | {{{potențial_de_ionizare_7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 8-a energie de ionizare | {{{potențial_de_ionizare_8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 9-a energie de ionizare | {{{potențial_de_ionizare_9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 10-a energie de ionizare | {{{potențial_de_ionizare_10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cei mai stabili izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unitățile SI și condiții de temperatură și presiune normale dacă nu s-a specificat altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifică text | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Actiniul este un element chimic radioactiv, notat cu simbolul Ac, descoperit în anul 1899 de către chimistul André-Louis Debierne având numărul atomic 89, iar masa atomică este de 227,0278 uam.[1][2][3] A fost primul element radioactiv care a fost izolat, deși poloniul, radiul și radonul erau observate înainte, însă neizolate până în anul 1902.[4][5] Este întâlnit sub forma a 36 de izotopi, cei mai stabili fiind 225Ac, 226Ac și 227Ac. A dat denumirea seriei actinidelor, un grup de 15 elemente asemănătoare între actiniu și lawrenciu în tabelul periodic.[1][6][7]


Actiniul este un metal foarte rar, fiind prezent în scoarța Pământului ca urme reziduale în minereurile de uraniu, cantitățile de actiniu din minereu fiind de ordinul miligramelor la o tonă de minereu brut. Răspândirea actiniului în scoarța terestră este de 5 · 10−14 %.[3][7][8]
Datorită intensității radioactivității sale, are puține domenii de utilizare, precum radioimunoterapia sau folosirea neutronilor emiși ca sursă energetică. În tehnologia chimică sau metalurgia clasică nu se cunosc aplicații industriale ale actiniului.[3][9]
Descoperire
[modificare | modificare sursă]După extracția poloniului și al radiului, în reziduurile de pehblendă se observa un material activ, care putea fi îndepărtat cu ajutorul pământurilor rare. Colaboratorul soților Curie, André-Louis Debierne, a descoperit că materialul activ consta în thoriu și cantități minuscule a unei noi substanțe radioactive. Acest preparat era de 100.000 de ori mai activ ca uraniul,[10] ceea ce-l făcuse să creadă că descoperise un nou element radioactiv. Acesta a observat că structura lui era similară titanului (1899).[11] sau thoriului (1900).[12] Deși nu a reușit separarea lui din thoriu, Debierne l-a numit actiniu. Acest lucru a fost complicat de tentativa lui de enunțare a unei teorii de radioactivitate, conform căreia aceasta este prezentă datorită actiniului.[10][13]
În 1902, Friedrich Otto Giesel publică un raport despre o substanță activă, obținută din pehblendă. Acesta arătase că substanța era caracterizată de o emisie de scurtă durată. Datorită intensității probelor ce le emitea, el a denumit substanța substanță emanantă[10] și mai târziu emaniu.[14] El considera că emisia din substanța sa era foarte diferită de cea a radiului. El a găsit următoarele diferențe: Emisia se transforma (aproximativ) într-o radiație...Noile raze o să le numesc pe scurt Raze-E.[10][15][16] Deoarece emaniul nu a fost separat de thoriu, Giesel concluzionează că substanța descoperită de el nu putea fi identică cu actiniul. Ulterior, Debierne afirmă că proprietățile sale chimice aveau o emisie similară cu cea a emaniului.[17] După multe controverse s-a ajuns la un acord în privința denumirii substanței ca actiniu.[18]
Opinia lui Ernest Rutherford despre actiniul lui Debierne și emaniul lui Giesel, exprimată în 1903, concluziona: Niciuna din aceste substanțe nu a fost studiată la fel de detaliat ca și uraniul, thoriul sau radiul, fiind nevoie de mai multe date comparative pentru natura radiațiilor și emisiilor, înainte ca orice concluzie să fie stabilită.[10][19]
După aproape trei decenii de la descoperirea lui Debierne, Kohlrausch a menționat despre actiniu, în lucrarea sa Radioactivitatea, că determinarea directă a unei greutăți atomice nu poate fi încă făcută deoarece greutatea disponibilă nu era suficientă.[10][20]
Istoria acestei descoperiri a rămas discutabilă, iar publicații din 1971, au arătat că cererile lui André-Louis Debierne din 1904 erau în contradicție cu cele din publicațiile anilor 1899 și 1900.[21] și mai târziu, în anul 2000[22]
Termenul de actiniu provine din cuvântul grecesc ακτίς, ακτίνoς, însemnând rază sau fascicul.
Structura atomică
[modificare | modificare sursă]Structura atomului de Actiniu este determinat de numărul nucleonilor din nucleul atomic, astfel pentru izotopul său natural, 227Ac, el are 89 de protoni și 138 neutroni.[23][9] Numărul neutronilor poate varia de la 117 până la 147 în funcție de izotop. Raza atomică medie este de 1,88Å, volumul molar al actiniului chimic pur în condiții fizice normale este de 22,54 cm3/mol.[1][2]
Învelișul electronic este format din 89 electroni care ocupă succesiv orbitalii păturilor cu începere de la pătura (stratul) K și terminând cu pătura Q. O particularitate a modului de completare a orbitalilor este aceea că se completează mai întâi subpătura interioară 5f,[24] această caracteristică fiind proprie tuturor elementelor din seria actinidelor și este cauza proprietăților chimice asemănătoare pe care le au aceste elemente. Numărul maxim de electroni care se pot afla în stare f este, potrivit principiului excluziunii al lui Pauli, egal cu 2(2l+1)=2(2·3+1)=14 (unde pentru numărul cuantic cinetic s-a luat valoarea l=3), de aceea trebuie să fie 14 actinide cu proprietăți analoage actiniului.[3][25] În notație spectroscopică, configurația electronică pentru starea fundamentală al atomului neutru de actiniu este prezentat mai jos, figura alăturată prezintă într-o manieră simplificată ocuparea nivelelor energetice de către cei 89 electroni legați[1][9]
| configurație electronică stratul electronic K: 1s2 stratul electronic L: 2s2p6 stratul electronic M: 3s2p6d10 stratul electronic N: 4s2p6d10f14 stratul electronic O: 5s2p6d10 stratul electronic P: 6s2p6d1 stratul electronic Q: 7s2 |
Electronii de pe stratul Q, care completează orbitalul 7s, respectiv unicul electron din substratul d al păturii P reprezintă electronii de valență ai actiniului. Necompletarea substratului d interior al păturii P este o consecință a diferenței energetice a orbitalilor din straturile superioare în acord cu legile mecanicii cuantice.[1][2][26] Substratul d incomplet este o caracteristică comună tuturor elementelor din seria actinidelor.[9][24] Structura proprie a învelișului electronic al atomului Ac determină în mare parte proprietățile fizico-chimice ale speciei atomice.[24] Asemănarea din punct de vedere al arajării electronilor în păturile electronice cu a elementelor din seria lantanidelor explică în mare parte similitudinile fizice ale celor 28 de elemente din cele două serii numite generic pământuri rare.[1][24] Electronii 6d1 și 7s2 aranjați în structura caracteristică actiniului sunt responsabili de majoritatea proprietăților chimice ale speciei atomice.
Răspândire pe Pământ
[modificare | modificare sursă]Actiniul este găsit în cantități mici în minereurile de uraniu, însă de obicei este fabricat, în cantități de ordinul miligramelor, prin iradierea izotopului 226Ra cu neutroni moderați (termalizați sau încetiniți) într-un reactor nuclear, reacția nucleară având loc după schema[27]:
Actiniul metalic a fost preparat prin reducerea fluorurii de actiniu cu vapori de litiu la temperaturi de 1100-1300 °C.[28]
Actiniul în natură este găsit doar ca urme ale izotopului său natural 227Ac, care este un emițător de radiații alfa și beta cu un timp de înjumătățire de 21,773 ani, prezent în minereurile de uraniu. O tonă de uraniu conține în medie o zecime de gram de actiniu.[29] Izotopul 227Ac este un membru de tranzit în seria dezintegrării actinidelor, care începe cu izotopul originar 235U (sau 239Pu), terminându-se cu izotopul stabil de plumb, 207Pb. Un alt izotop (225Ac) este un tranzitor prezent în seria neptuniului, care începe cu 237Np (sau 233U) și se încheie cu elementul, aproape stabil, bismut (209Bi).
Proprietăți fizice
[modificare | modificare sursă]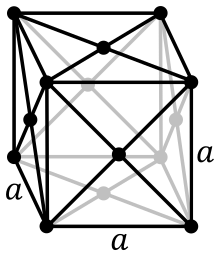
Actiniul este un element radioactiv metalic, de culoare argintie. Datorită radioactivității sale intense, acesta emite radiații percepute ca o lumină albastră.
Actiniul metalic este obținut prin reducerea AcF3 cu vapori de litiu. Structura sa cristalină are celulă elementară cubică cu fețe centrate și este asemănător cu lantanul ca rază ionică, culoare, etc.[28] Densitatea actiniului este de 10,07 g·cm−3, fiind al 71-lea element ca densitate.[30][31]
Punctul de topire al actiniului este de 1050°C (sau in celelalte scări de temperatură 1922°F, respectiv 1323 K). Punctul de fierbere al acestui metal este de 3300 °C (sau 3471 K, respectiv 5788°F).
Difuzia emisiilor actiniului
[modificare | modificare sursă]
Datorită timpului de înjumătățire a emisiilor actiniului și al thoriului, în general nu este posibilă determinarea constantei de difuzie prin metodele folosite pentru emisiile radiului. Totuși, valoarea lui D poate fi măsurată prin următorul procedeu care permite obținerea unor rezultate optime.[32]
O placă C acoperită cu hidroxid de thoriu este plasată orizontal lângă baza unui cilindru de alamă P. Emisia thoriului difuzează ascendent în cilindru. O stare de echilibru este atinsă atunci când rata creșterii numărului atomilor din emisie raportat la unitatea de volum al difuziei ascendente este egalată de rata scăderii datorită transformării emisiei.
Dacă N este numărul de atomi ai emisiei raportat la unitatea de volum, presupusă a fi uniformă, de-a lungul secțiunii transversale, la o distanță x față de thoriu, avem relația:
unde: λ este constanta emisiei radioactive
Difuzia emisiilor actiniului în aer au fost măsurate de Debierne, Russ și Bruhat.[33][34][35]. Montajul experimental folosit de către Debierne măsura emisia provenită din preparatul actinic prin două plăci paralele, așezate vertical și apropiate. Pentru a asigura o temperatură constantă în interiorul cilindrului, aparatul era imersat într-o baie de apă, aceasta având rol de termostat.[36]
Russ examinase difuzia emisiei actinice cu aerul, hidrogenul[37], dioxidul de carbon și dioxidul de sulf, găsind valori relative în acord cu legea lui Graham.[38]
Fosforescență
[modificare | modificare sursă]Proprietatea emisiei actiniului a fost ilustrată de Giesel printr-un experiment.[39] Un preparat actinic foarte activ, atașat de o coală subțire de hârtie, este plasat pe un ecran fosforescent de sulfurat de zinc. Într-o cameră întunecoasă, preparatul activ eliberează pe o anumită distanță emisii fosforescente, marcate de scintilațiile caracteristice. Direcționarea unui curent de aer asupra ecranului face ca fosforescența să fie deplasată în direcția curentului, devenind mai slabă. O mare parte a fosforescenței observate inițial era datorată emisiei actiniului care difuzase prin coala subțire plasată peste suprafața ecranului. Oprirea curentului de aer are ca efect reapariția fosforescenței intense a ecranului.
Proprietăți chimice
[modificare | modificare sursă]Actiniul are un caracter chimic similar lantanului.[40] Datorită acestei similitudini, separarea actiniului de lantan și celelalte elemente din categoria pământurilor rare, care sunt prezente și în minereurile de uraniu, este dificilă. Extracția prin solvenți și cromatografia schimbului electronic au fost metodele folosite la separare. Actiniul formează fluoruri, hidroxizi, oxalați și fosfați insolubili în apă.[41].
Compușii chimici ai actiniului
[modificare | modificare sursă]Doar un număr limitat de compuși ai actiniului sunt cunoscuți, cum ar fi: AcF3, AcCl3, AcBr3, AcOF, AcOCl, AcOBr, Ac2S3, Ac2O3 și AcPO4. Toți compușii menționați sunt similari cu cei ai lantanului, arătând că, în general, compușii actiniului prezintă starea de oxidare +3.[42]
Hidruri
[modificare | modificare sursă]Actiniul reacționează cu hidrogenul la temperatura de 200 °C, formând hidruri[43] non-stoechiometrice, casante, de culoare închisă, care sunt bune conducătoare de electricitate.[43][44] AcH2 poate să reacționeze cu hidrogenul pentru a forma AcH3, având ca rezultat pierderea conductivității electrice. AcH3 este o substanță neagră în care atomii de hidrogen ocupă noduri ale unui sistem tetraedric sau octogonal într-un aranjament cubic sau hexagonal de Ac3+.
Halogenuri
[modificare | modificare sursă]AcF3 folosit la obținerea actiniului se prepară la 700 °C prin acțiunea HF asupra Ac2O3 sau prin precipitarea în soluție cu o fluorură. Trifluorura de actiniu este o substanță stabilă la încălzire, iar procesul de pirohidroliză are loc doar la temperaturi de 1000 °C, în prezența amoniacului și a vaporilor de apă, având loc trecerea în AcOF.[45] Totodată trifluorura este o sursă[46] de neutroni pe baza reacției 19F()22Na, la o cantitate de 1 Ci actiniu corespunzând 1,21*106n/s.
AcCl3 se prepară din Ac(OH)3 cu CCl4 la 950 °C, când se obține un produs cu simetrie hexagonală similar cu a UCl3, în care actiniul este înconjurat de 9 atomi de clor. Produsul obținut este higroscopic și prin hidroliză parțială trece în AcOCl.[45] AcBr3 se prepară la 750 °C din Ac2O3 și AlBr3. Tribromura este higroscopică și cu solubilitate mare în apă.[45] AcI3 este preparat la temperatura de 550 °C din reacția Ac2O3 și NH4I.[45] Este o substanță cu solubilitate mare în apă.
Dintre oxihalogenuri se amintesc AcOF, AcOCl, AcOBr.[45]
Alți compuși
[modificare | modificare sursă]Se cunoaște oxidul Ac2O3, care este obținut prin descompunerea oxalatului Ac2(OX)3. Totodată, este obținut și ca rezultat al reactivității mari cu aerul, iar oxidul format protejează metalul de oxidarea completă. Oxidul prezintă o structură cu simetrie hexagonală.
Sulfura de actiniu se prepară în urma reacției dintre oxidul de actiniu cu acidul sulfhidric și sulfura de carbon, la temperatura de 1100 °C.
Oxalatul de actiniu, Ac2(OX)3*H2O, este preparat din soluție de Ac3+ în H-COOH la 90 °C, introducând dimetiloxalat care va produce ionul oxalat necesar prin procesul de hidroliză.
Compușii respectivi sunt obținuți conform reacțiilor:[45]
- Ac2O3 + 6HF→2AcF3 + 3H2O
- 4Ac(OH)3 + 3CCl4 →4AcCl3 + 3CO2 + 6H2O
- 4Ac + 3O2→2Ac2O3
- Ac2O3 + 2AlBr3→2AcBr3 + Al2O3
- Ac2O3 + 2Al + 3I2 →2AcI3 + Al2O3
Actinidele
[modificare | modificare sursă]Actinidele reprezintă seria chimică, constituită din 15 elemente chimice, care începe cu actiniul (Z=89) și se termină cu lawrenciul (Z=103). Primele 4 actinide sunt întâlnite în natură (actiniul, thoriu, protactiniul și uraniul), fiind ușor detectabile în sol. Neptuniul și restul actinidelor sunt considerate a fi sintetizabile pe cale artificială, datorită concentrației foarte mici ale acestora în scoarța Pământului.
Actiniul este primul element din seria actinidelor, denumind gruparea după numele său, la fel ca lantanul, ce denumește seria lantanidelor. Grupul de elemente este mult mai complex decât cel al lantanidelor. Abia în anul 1945, tabelul lui Mendeleev a fost modificat de Glenn T. Seaborg, prin propunerea introducerii actinidelor în sistemul periodic al elementelor. Seria actinidelor este constituită din următoarele metale:
- Actiniu - 1899, descoperit de francezul André-Louis Debierne
- Thoriu – 1828, descoperit de suedezul Jöns Jakob Berzelius
- Protactiniu – 1918, descoperit de două grupuri de cercetători, unul englez (Frederick Soddy, John Cranston) și unul german (Otto Hahn, Lise Meitner)[47]
- Uraniu – 1789, descoperit de germanul Martin Heinrich Klaproth
- Neptuniu – 1941, descoperit de americanii Edwin McMillan și Philip H. Abelson[48]
- Plutoniul (1940), americiul (1945), curiul (1944), berkeliul (1949), californiul (1949), mendeleeviul (1955), nobeliul (1957) și lawrenciul (1961) au fost elementele chimice descoperite de către Glenn T. Seaborg
- Einsteiniul (1953) și fermiul (1952) au fost descoperite de Albert Ghiorso.
La actinide se manifestă fenomenul de paramagnetism.[49]
Izotopii
[modificare | modificare sursă]În mod normal, actiniul prezintă un singur izotop natural radioactiv, 227Ac și niciun izotop stabil. 36 de radioizotopi au fost sintetizați artificial, cei mai stabili fiind 227Ac cu un timp de înjumătățire de T1/2=21,772 ani, 225Ac cu T1/2=10 zile și 226Ac, care se dezintegrează cu T1/2=29,37 ore. Toți ceilalți izotopi radioactivi au timpi de înjumătățire mai mici de 10 ore, iar majoritatea acestora au timpi de înjumătățire mai mici de un minut. Izotopul actiniului care există pentru cel mai scurt timp este 217Ac, care se transformă prin dezintegrare alfa și captură de electroni.[50] Are un timp de înjumătățire de 69 nanosecunde. Actiniul are și 2 izomeri nucleari.[51]
227Ac chimic pur intră în stare de echilibru cu produșii săi rezultați din procesul de dezintegrare la sfârșitul a 185 de zile, iar apoi se descompune în perioada de 21,773 ani. Izotopii actiniului sunt cuprinși în intervalul de mase atomice de la 206 unități atomice de masă (206Ac) la 236 u.a.m.[51]
Izotopii actiniului sunt prezentați în tabelul de mai jos:[52][53]
| Simbolul izotopului | Z(p) | N(n) | Masa izotopului(u) | Timp de înjumătățire |
|---|---|---|---|---|
| energia de excitare a izotopului | ||||
| 206Ac | 89 | 117 | 206,01450(8) | 25(7) ms |
| 206m1Ac | 80(50) keV | 15(6) ms | ||
| 206m2Ac | 290(110) keV | 41(16) ms | ||
| 207Ac | 89 | 118 | 207,01195(6) | 31(8) ms [27(+11-6) ms] |
| 208Ac | 89 | 119 | 208,01155(6) | 97(16) ms [95(+24-16) ms] |
| 208mAc | 506(26) keV | 28(7) ms [25(+9-5) ms] | ||
| 209Ac | 89 | 120 | 209,00949(5) | 92(11) ms |
| 210Ac | 89 | 121 | 210,00944(6) | 350(40) ms |
| 211Ac | 89 | 122 | 211,00773(8) | 213(25) ms |
| 212Ac | 89 | 123 | 212,00781(7) | 920(50) ms |
| 213Ac | 89 | 124 | 213,00661(6) | 731(17) ms |
| 214Ac | 89 | 125 | 214,006902(24) | 8,2(2) s |
| 215Ac | 89 | 126 | 215,006454(23) | 0,17(1) s |
| 216Ac | 89 | 127 | 216,008720(29) | 0,440(16) ms |
| 216mAc | 44(7) keV | 443(7) µs | ||
| 217Ac | 89 | 128 | 217,009347(14) | 69(4) ns |
| 217mAc | 2012(20) keV | 740(40) ns | ||
| 218Ac | 89 | 129 | 218,01164(5) | 1,08(9) µs |
| 218mAc | 584(50)keV | 103(11) ns | ||
| 219Ac | 89 | 130 | 219,01242(5) | 11,8(15) µs |
| 220Ac | 89 | 131 | 220,014763(16) | 26,36(19) ms |
| 221Ac | 89 | 132 | 221,01559(5) | 52(2) ms |
| 222Ac | 89 | 133 | 222,017844(6) | 5,0(5) s |
| 222mAc | 200(150)keV | 1,05(7) min | ||
| 223Ac | 89 | 134 | 223,019137(8) | 2,10(5) min |
| 224Ac | 89 | 135 | 224,021723(4) | 2,78(17) h |
| 225Ac | 89 | 136 | 225,023230(5) | 10,0(1) zile |
| 226Ac | 89 | 137 | 226,026098(4) | 29,37(12) h |
| 227Ac | 89 | 138 | 227,0277521(26) | 21,772(3) a |
| 228Ac | 89 | 139 | 228,0310211(27) | 6,15(2) h |
| 229Ac | 89 | 140 | 229,03302(4) | 62,7(5) min |
| 230Ac | 89 | 141 | 230,03629(32) | 122(3) s |
| 231Ac | 89 | 142 | 231,03856(11) | 7,5(1) min |
| 232Ac | 89 | 143 | 232,04203(11) | 119(5) s |
| 233Ac | 89 | 144 | 233,04455(32) | 145(10) s |
| 234Ac | 89 | 145 | 234,04842(43) | 44(7) s |
| 235Ac | 89 | 146 | 235,05123(38) | 40s |
| 236Ac | 89 | 147 | 236,05530(54) | 2 min |
Utilizări
[modificare | modificare sursă]Este de aproximativ 150 de ori mai radioactiv ca radiul, făcându-l valoros ca sursă energetică datorită neutronilor. În combinație cu beriliul, este utilizat în generarea neutronilor pentru activarea analizelor minereurilor sau aliajelor.[54] Altfel, acesta nu are nici o aplicație industrială semnificativă.[55]
225Ac este utilizat în medicină pentru a produce 213Bi într-un generator reutilizabil sau poate fi folosit individual ca un agent pentru radio-imonoterapia pentru Targeted Alpha Therapy (TAT, Terapia Alfa Orientata).[56] 225Ac a fost produs artificial pentru prima oară de Institutul pentru Elementele Transuraniene (Institute for Transuranium Elements-ITU) în Germania, folosindu-se un ciclotron și de către doctorul Graeme Melville la Spitalul Saint George în Sydney, folosind un accelerator liniar de particule în 2000.[57]
Aspecte de securitate și sănătate
[modificare | modificare sursă]227Ac este extrem de radioactiv, iar potențialul de radiație induce efecte nocive asupra sănătății.[58] 227Ac este chiar mai periculos decât plutoniul. Este extrem de toxic,[59][60] ingerarea sa având o acțiune toxicologică mult mai pronunțată decât în cazul acidului cianhidric. Actiniul ajuns în organism se depozitează în straturile superficiale ale oaselor,[61][62] având o acțiune distrugătoare asupra lor prin emisiile radioactive ale acestuia.
Efectele actiniului asupra organismului datorate radiaților emise de acesta sunt apariția cancerului[63], distrugerea sistemului imunitar, leucemia, pierderile de sarcină, apariția malformaților și afectarea fertilității.
Vezi și
[modificare | modificare sursă]Bibliografie
[modificare | modificare sursă]în limba română
[modificare | modificare sursă]- Berinde, Alexandru: Teoria reactorilor nucleari, Editura Didactică și Pedagogică, București, 1962
- Beral, Edith și Zapan, Mihai: Chimie generală, Editura Tehnică, București, 1976
- Bunuș, Florin: ACTINIDE și aplicațiile lor, Editura Științifică și enciclopedică, București, 1981
- Marcu, Gheorghe și colectiv: Chimie Anorganică, Editura didactică și pedagogică, București, 1981
- Marcu, Gheorghe: Chimia elementelor radioactive, Editura didactică și pedagogică, București, 1971
- Muhin, K.N.: Fizică nucleară experimentală-volumul I: Fizica nucleului atomic (traducere din limba rusă), Editura tehnică, București, 1981
- Murgulescu, I. G. și Sahini, V. Em: Introducere în Chimia Fizică, Editura Academiei, București, 1978, vol. I.2
- Nenițescu, C.D.: Chimie generală, Editura Didactică și Pedagogică, București, 1986
- Șandru, P. și Țopa, A: Radionuclizi, Editura Academiei R.S.R, București, 1969
în alte limbi
[modificare | modificare sursă]- fr Avaan,L et Avan, M: Cours de physique nucléaire, Industrie Atomiques, no.5-6, Paris, 1964
- en Gonis, A., Borovoi, A. A., Sterne, P. A.: Actinides and the Environment, NATO ASI Series, 2.Environment - Vol.41
- en Holleman, Arnold F. Wiberg, Egon: Inorganic chemistry, Science, 2001
- en Mlađenović, Milorad: The history of early nuclear physics (1896-1931)
- en Rutherford, Ernest: Radioactive Substances and Their Radiations, The University press, 1913, ISBN 978-1-4067-4805-5
Note
[modificare | modificare sursă]- ^ a b c d e f Nenițescu, op. cit., pag. 611–615
- ^ a b c Murgulescu, op. cit., pag 317
- ^ a b c d Șandru, op. cit, pag. 221–223
- ^ op. cit, pag. 221–223
- ^ Muhin, op. cit, pag 245
- ^ Beral, op. cit, pag. 452
- ^ a b Avaan, op. cit, pag. 222–245
- ^ Marcu, op. cit., pag.351
- ^ a b c d Beral, op. cit., pag 456
- ^ a b c d e f Mlađenović, op.cit. pag.10–11
- ^ Debierne, André-Louis (). „Sur un nouvelle matière radio-active”. Comptes rendus. 129: 593–595.
- ^ Debierne, André-Louis (). „Sur un nouvelle matière radio-actifl'actinium”. Comptes rendus. 130: 906–908.
- ^ A.Debierne, C.R 129, 593 (1899); 130, 196 și 906 (1900)
- ^ Giesel, Friedrich Oskar (). „Ueber den Emanationskörper (Emanium)”. Berichte der Deutschen Chemische Geselschaft. 37 (2): 1696–1699. doi:10.1002/cber.19040370280.
- ^ F.Giesel, Ber.deutsch. chem. Ges. 35, 3608 (1902); 36, 342 (1903)
- ^ Radioactivitatea, Ernest Rutherford, pagina 287
- ^ Debierne, C.R 139, p.538, 1904
- ^ Giesel, Ber.d.D. Chem.Ges 35, p.3968, 1904; 38, p.775, 1905, Debierne, Phys, Yeit. 7, p.14, 1906
- ^ Ernest Rutherford, Radioactivitatea, pagina 24
- ^ Kohlrausch, Radioaktivitat, pagina 750
- ^ Kirby, H. W. (). „The Discovery of Actinium”. Isis. 62 (3): 290–308. doi:10.1086/350760. JSTOR 229943.
- ^ Adloff, J. P. (). „The centenary of a controversial discovery: actinium”. Radiochim. Acta,. 88 (3–4_2000): 123–128. doi:10.1524/ract.2000.88.3-4.123.
- ^ Nenițescu, op. cit., pag. 611-615
- ^ a b c d Muhin, op. cit, pag 530
- ^ Muhin, op. cit, pag. 531
- ^ Șandru, op. cit, pag. 221-223
- ^ Berinde, op. cit. pag. 117
- ^ a b Bunuș, op cit. pag. 23
- ^ Chimie Anorganica, Editura didactica si pedagogica, Bucuresti, 1981, autorii Gheorghe Marcu, Maria Brezeanu, Cornelia Bejan, Agneta Batca, Rodica Catuneanu, pagina 263, Tabela 11.12
- ^ Lester R. Morss, Norman M. Edelstein, Jean Fuger, The Chemistry of the Actinide and Transactinide Elements. Springer Netherlands, 2006. ISBN 978-1-4020-3555-5.
- ^ en Periodic Table of Elements: Sorted by Density. EnvironmentalChemistry.com. Accesat la 7 august 2009.
- ^ Ernest Rutherford, Radioactive Substances and Their Radiations,p.387 ,
- ^ Debierne, Le Radium, 4, p.213, 1907
- ^ Russ, Phil.Mag.17, p.412, 1909
- ^ Bruhat, C.R.148, P.628, 1909; Le Radium.6, p.67, 1909
- ^ Radioactive Substances and Their Radiations, E. Rutherford, pagina 388
- ^ Ernest Rutherford, Radioactive Substances and Their Radiations, p.389
- ^ Radioactive Substances and Their Radiations, E. Rutherford, pagina 389
- ^ Radioactive Substances and Their Radiations, E. Rutherford, pagina 19
- ^ Stites, Joseph G. (). „Preparation of Actinium Metal”. J. Am. Chem. Soc. 77 (1): 237–240. doi:10.1021/ja01606a085.
- ^ Katz, J. J. (). „Chemistry of the Actinide Elements Annual Review of Nuclear Science”. Annual Review of Nuclear Science. 1: 245–262. doi:10.1146/annurev.ns.01.120152.001333.
- ^ Sherman, Fried (). „The Preparation and Identification of Some Pure Actinium Compounds”. Journal of the American Chemical Society. 72 (2): 771–775. doi:10.1021/ja01158a034.
- ^ a b Inorganic chemistry, Arnold F. Holleman, Egon Wiberg, pagina 1322
- ^ la fel ca și scandiul, ytriul, lantanul
- ^ a b c d e f Bunuș, op cit. pag. 24
- ^ Gheorghe Marcu, Chimia elementelor radioactive, Editura didactică și pedagogică, București, 1971, pagina 352
- ^ Lise Meitner and the dawn of the nuclear age, Patricia Rife, Lise Meitner, pagina 72-77
- ^ Actinides and the Environment, Gonis, A., Borovoi, A. A., Sterne, P. A., pagina 5
- ^ Bursuc, I.D. (). Solidul. Fenomene, teorii, aplicații. București: Editura Științifică. pp. 285, 296. ISBN 973-44-0037-1.
- ^ Considine, Glenn D., ed. (2005), Chemical Elements, Van Nostrand's Encyclopedia of Chemistry, New York: Wylie-Interscience, pp. 332, 0-471-61525-0
- ^ a b Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A.H. (). „The NUBASE Evaluation of Nuclear and Decay Properties”. Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ en Isotopes of actinium. nationmaster.com. Accesat la 23 iulie 2009.
- ^ en Isotopes of actinium. education.jlab.org. Accesat la 23 iulie 2009.
- ^ Inorganic chemistry, Arnold F. Holleman, Egon Wiberg, pagina 1321
- ^ Dixon, W.R. (). „Neutron Spectrum of an Actinium–Beryllium Source”. Can. J. Phys./Rev. Can. Phys. 35 (6): 699–702. doi:10.1139/p57-075.[nefuncțională]
- ^ Bolla, Rose A. (). „Production of actinium-225 for alpha particle mediated radioimmunotherapy”. Applied Radiation and Isotopes. 62 (5): 667–679. doi:10.1016/j.apradiso.2004.12.003. PMID 15763472.
- ^ Melville, G; Allen, Bj (). „Cyclotron and linac production of Ac-225”. Applied radiation and isotopes : including data, instrumentation and methods for use in agriculture, industry and medicine. 67 (4): 549–55. doi:10.1016/j.apradiso.2008.11.012. ISSN 0969-8043. PMID 19135381.
- ^ Langham, W. (). „Toxicology of Actinium Equilibrium Mixture”. Los Alamos Scientific Lab.: Technical Report. doi:10.2172/4406766.
- ^ Chimie Anorganica, Editura didactica si pedagogica, Bucuresti, 1981, autorii Gheorghe Marcu, Maria Brezeanu, Cornelia Bejan, Agneta Batca, Rodica Catuneanu
- ^ Lewis' dictionary of toxicology, Robert Alan Lewis, pagina 23
- ^ The history and use of our earth's chemical elements, Robert E. Krebs, pagina 308
- ^ en Wall, Greg. „Actinium”. Accesat la data de 17 iunie 2009.
- ^ Chemical properties of actinium - Health effects of actinium - Environmental effects of actinium. lenntech.com. Accesat la 7 august 2009.
Legături externe
[modificare | modificare sursă]- http://www.webelements.com/webelements/elements/text/Ac/index.html
- http://environmentalchemistry.com/yogi/periodic/Ac.html
- http://education.jlab.org/itselemental/ele089.html
- http://www.tabulka.cz/prvky/ukaz.asp?id=89 Arhivat în , la Wayback Machine.
- http://www.periodieksysteem.com/elem_nl.cfm?IDE=Ac Arhivat în , la Wayback Machine.
- http://www.lenntech.com/Periodic-chart-elements/Ac-en.htm
| |||||||||||||||||||||||||||||||||||||


 French
French Deutsch
Deutsch![{\displaystyle \mathrm {^{226}_{\ 88}Ra\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 88}^{227}Ra\ {\xrightarrow[{42,2\ min}]{\beta ^{-}}}\ _{\ 89}^{227}Ac} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9ead92b5741b8d2dc958c429e610f57b59c0d95)

