铁硫蛋白 - 维基百科,自由的百科全书
此條目需要擴充。 (2011年9月15日) |
铁硫蛋白(英語:Iron-sulfur protein,或称为铁硫蛋白质)是一类蛋白质,其特征是其中存在着铁-硫簇,铁-硫簇中含有与硫连接着的二、三或四个铁中心,并可处于各种变化的氧化态上。铁-硫簇存在于多种金属蛋白之中,例如铁氧还蛋白、氢化酶、辅酶Q-细胞色素c氧化酶、琥珀酸脱氢酶,和固氮酶等[1]。铁硫蛋白是粒線體中执行氧化磷酸化過程的重要成员,像電子傳遞鏈中的第一蛋白複合體(Complex I)及第二蛋白複合體(Complex II)都含有鐵硫簇。此外,像是順烏頭酸酶和SAM依賴蛋白中也有鐵硫簇,另外硫辛酸及生物素的合成也牽涉到鐵硫簇。可見鐵硫簇的作用範圍包括呼吸作用、光合作用、羟化作用以及细菌的氢和氮的固定。
鐵硫蛋白可用基因表現來調控,且容易被一氧化氮破壞。
由于这些蛋白质在大多数生物体的代谢途径上的普遍性,导致一些科学家理论化铁-硫化合物在铁-硫世界理论中的生命起源的探讨中扮演重要角色。
结构模体
[编辑]在几乎所有的铁硫蛋白中,Fe中心都是四面体,末端配体是半胱氨酸残基的硫醇基硫中心。 硫化物基团是两个或三个配位的。 具有这些特征的三种不同类型的Fe–S簇最为常见。
2Fe–2S簇
[编辑]
最简单的多金属系统[Fe2S2]簇由两个铁离子组成,两个铁离子桥接两个硫离子,并由四个半胱氨酸配体(在Fe2S2铁氧还蛋白中)或两个半胱氨酸和两个组氨酸(在里斯克蛋白质中)配位。 被氧化的蛋白质包含两个Fe3+离子,而被还原的蛋白质包含一个Fe3+和一个Fe2+离子。 这些物质以两种氧化态(FeIII)2和FeIIIFeII存在。 CDGSH铁硫结构域也与2Fe-2S簇相关。
4Fe–4S簇
[编辑]一个常见的模体具有四个铁离子和四个硫化物离子,它们位于立方体式簇的各个顶点上。 Fe中心通常由半胱氨酰基配体进一步配位。 [Fe4S4]电子转移蛋白([Fe4S4]铁氧还蛋白)可以进一步细分为低电位(细菌型)和高电位(HiPIP)铁氧还蛋白。低电位和高电位铁氧还蛋白与以下氧化还原方案相关:

3Fe–4S簇
[编辑]还已知蛋白质包含[Fe3S4]中心,其特征是比更常见的[Fe4S4]核心少一个铁。 三个硫化物离子分别桥接两个铁离子,而第四个硫化物桥接三个铁离子。
其他的Fe–S簇
[编辑]更复杂的多金属系统是常见的。 例子包括固氮酶中的8Fe和7Fe簇。 一氧化碳脱氢酶和[FeFe]-氢化酶还具有不寻常的Fe–S簇。 在耐氧膜结合的[NiFe]氢化酶中发现了一个特殊的6个半胱氨酸配位的[Fe4S3]簇[2][3]。
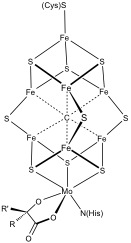
生物合成
[编辑]Fe-S簇的生物合成已经被很好的研究[4][5][6]。铁硫簇的生物发生已在大肠杆菌,葡萄曲霉和酿酒酵母这三种细菌中得到了最广泛的研究。 迄今为止,至少鉴定了三种不同的生物合成系统,即nif,suf和isc系统,它们首先在细菌中鉴定出来。 nif系统负责硝化酶中的簇。 suf和isc系统更为通用。
参阅
[编辑]参考文献
[编辑]- ^ S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ^ Fritsch, J; Scheerer, P; Frielingsdorf, S; Kroschinsky, S; Friedrich, B; Lenz, O; Spahn, CMT. The crystal structure of an oxygen-tolerant hydrogenase uncovers a novel iron-sulphur centre. Nature. 2011-10-16, 479 (7372): 249–252. PMID 22002606. doi:10.1038/nature10505.
- ^ Shomura, Y; Yoon, KS; Nishihara, H; Higuchi, Y. Structural basis for a [4Fe-3S] cluster in the oxygen-tolerant membrane-bound [NiFe]-hydrogenase. Nature. 2011-10-16, 479 (7372): 253–256. PMID 22002607. doi:10.1038/nature10504.
- ^ Johnson D, Dean DR, Smith AD, Johnson MK. Structure, function and formation of biological iron–sulfur clusters. Annual Review of Biochemistry. 2005, 74 (1): 247–281. PMID 15952888. doi:10.1146/annurev.biochem.74.082803.133518.
- ^ Johnson, M.K. and Smith, A.D. (2005) Iron–sulfur proteins in: Encyclopedia of Inorganic Chemistry (King, R.B., Ed.), 2nd edn, John Wiley & Sons, Chichester.
- ^ Lill R, Mühlenhoff U. Iron–sulfur-protein biogenesis in eukaryotes. Trends in Biochemical Sciences. 2005, 30 (3): 133–141. PMID 15752985. doi:10.1016/j.tibs.2005.01.006
 .
.
深入阅读
[编辑]- H. Beinert. Iron-sulfur proteins: ancient structures, still full of surprises. Journal of biological inorganic chemistry: JBIC: a publication of the Society of Biological Inorganic Chemistry. 2000-02, 5 (1): 2–15 [2019-02-12]. ISSN 0949-8257. PMID 10766431. (原始内容存档于2016-03-06).
- H. Beinert, P. J. Kiley. Fe-S proteins in sensing and regulatory functions. Current Opinion in Chemical Biology. 1999-04, 3 (2): 152–157 [2019-02-12]. ISSN 1367-5931. PMID 10226040. doi:10.1016/S1367-5931(99)80027-1. (原始内容存档于2016-03-05).
- M. K. Johnson. Iron-sulfur proteins: new roles for old clusters. Current Opinion in Chemical Biology. 1998-04, 2 (2): 173–181 [2019-02-13]. ISSN 1367-5931. PMID 9667933. (原始内容存档于2016-03-04).
- Bettina Böttcher, Sigrid Unseld, Hugo Ceulemans, Robert B. Russell, Holger Jeske. Geminate Structures of African Cassava Mosaic Virus. Journal of Virology. 2004-07, 78 (13): 6758–6765 [2019-02-13]. ISSN 0022-538X. PMC 421685
 . PMID 15194750. doi:10.1128/JVI.78.13.6758-6765.2004. (原始内容存档于2019-07-01).
. PMID 15194750. doi:10.1128/JVI.78.13.6758-6765.2004. (原始内容存档于2019-07-01). - Louis Noodleman, Timothy Lovell, Tiqing Liu, Fahmi Himo, Rhonda A. Torres. Insights into properties and energetics of iron-sulfur proteins from simple clusters to nitrogenase. Current Opinion in Chemical Biology. 2002-04, 6 (2): 259–273 [2019-02-13]. ISSN 1367-5931. PMID 12039013. (原始内容存档于2009-02-16).
- Spiro, T.G., Ed. Iron-sulfur proteins. New York: Wiley. 1982. ISBN 0-471-07738-0.


 French
French Deutsch
Deutsch