Силиций – Уикипедия
Силиций (на латински: Silicium), Si е химичен елемент от група 14, период 3. Атомният му номер е 14 и е с атомна маса 28,0855 u.
Силицият е вторият по разпространение химичен елемент в земната кора след кислорода. Той не съществува в свободно състояние, а под формата на силициев диоксид (в пясъка, кварц) или като силикат (каолин).
Името му произлиза от латинските думи silex, silicis и означава кремък.
История
[редактиране | редактиране на кода]Силицият бил познат още в древността под формата на кремък и бил изолиран за първи път в чиста форма от Берцелиус през 1823 г.
Изотопи
[редактиране | редактиране на кода]Съществуват три естествени изотопа на силиция 28Si (92,18%), 29Si (4,71%) и 30Si (3,12%) и няколко получени по изкуствен път 25Si, 26Si, 27Si, 31Si, 32Si
Свойства
[редактиране | редактиране на кода]Физични свойства
[редактиране | редактиране на кода]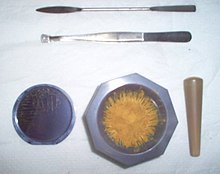
Силицият в чист вид, при нормална температура, е твърдо вещество с кристална структура, със сиво-черен цвят и метален блясък. В тази форма в природата се среща рядко – като кристали в златната руда и във вулканичните изпарения. Елементът е разпространен на Земята най-често като силициев диоксид (SiO2) под формата на кварц или кремък (основна съставна част на пясъка). Има температура на топене 1414 °C, температура на кипене 3265 °C и плътност 2330 kg/m3. Не се разтваря във вода. Силицият е полупроводник, има отрицателен температурен коефициент на съпротивлението. Единичен кристал силиций притежава пиезорезистивен ефект, а кварцовите кристали – пиезоелектричен ефект.
Химични свойства
[редактиране | редактиране на кода]Силицият е сравнително инертен към киселини – не взаимодейства, освен със смес от азотна (HNO3) и флуороводородна киселина (HF). Взаимодейства с основи и халогени.
Взаимодействие с въздуха
[редактиране | редактиране на кода]Повърхността на кристалите на силиция са покрити от тънък слой силициев диоксид (SiO2), което не позволява на останалата част от атомите, които се намират под този слой, да реагират с въздуха при температури до 900 °C. При по-високи температури се получава реакция с кислорода и се образува силициев диоксид, а при температури над 1400 °C силицият реагира с азота във въздуха и образува силициевите нитриди SiN и Si3N4.
Si + O2 → SiO2
2Si + N2 → 2SiN
3Si + 2N2 → Si3N4
Взаимодействие с халогенни елементи
[редактиране | редактиране на кода]Силицият взаимодейства енергично с халогенните елементи и образува силициеви тетрахалогениди. Реакцията с флуора протича при нормална температура, докато с други халогенни елементи е необходимо температура над 300 °C.
Si + 2F2 → SiF4 (силициев тетрафлуорид)
Si + 2Cl2 → SiCl4 (силициев тетрахлорид)
Si + 2Br2 → SiBr4 (силициев тетрабромид)
Si + 2I2 → SiI4 (силициев тетрайодид)
Взаимодействие с киселини
[редактиране | редактиране на кода]Силицият не реагира с повечето киселини при нормални условия. Изключение прави флуороводорода и азотната киселина.
Si + 6HF → [SiF6]2- + 2H+ + 2H2
Взаимодействие с основи
[редактиране | редактиране на кода]Si + 4NaOH → [SiO4]4- + 4Na+ + 2H2
Разпространение и употреба
[редактиране | редактиране на кода]Основен материал в съвременната електроника (производство на транзистори и интегрални схеми). Използва се също за производство на слънчеви батерии. Кварцът служи за направа на кварцови резонатори.
Биологични ефекти
[редактиране | редактиране на кода]Техника на безопасност
[редактиране | редактиране на кода]Източници
[редактиране | редактиране на кода]- ↑ Ram, R. S. Fourier Transform Emission Spectroscopy of the A2D–X2P Transition of SiH and SiD // J. Mol. Spectr. 190. 1998. p. 341 – 352. Архивиран от оригинала на 2012-02-09. Посетен на 2018-01-20. (на английски)
- ↑ Eranna, Golla. Crystal Growth and Evaluation of Silicon for VLSI and ULSI. CRC Press, 2014. ISBN 978-1-4822-3281-3. p. 7. (на английски)
- ↑ ((en)) Magnetic susceptibility of the elements and inorganic compounds Архив на оригинала от 2011-03-03 в Wayback Machine.
- ↑ а б в г Hopcroft, Matthew A. et al. What is the Young's Modulus of Silicon? // Journal of Microelectromechanical Systems 19 (2). 2010. DOI:10.1109/JMEMS.2009.2039697. p. 229. (на английски)
- ↑ Weeks, Mary Elvira. The discovery of the elements: XII. Other elements isolated with the aid of potassium and sodium: beryllium, boron, silicon, and aluminum // Journal of Chemical Education 9 (8). 1932. DOI:10.1021/ed009p1386. p. 1386 – 1412. (на английски)
- ↑ Voronkov, M. G. Silicon era // Russian Journal of Applied Chemistry 80 (12). 2007. DOI:10.1134/S1070427207120397. p. 2190. (на английски)
Периодична система на елементите | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||


 French
French Deutsch
Deutsch
