Alcoli
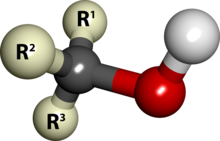

In chimica, gli alcoli sono una categoria di composti organici che contengono almeno un gruppo funzionale idrossile (-OH) legato a un atomo di carbonio saturo. Gli alcol vanno dai più semplici, come il metanolo e l'etanolo, ai più complessi, come il saccarosio e il colesterolo. La presenza di un gruppo OH modifica fortemente le proprietà degli idrocarburi, conferendo loro proprietà idrofiliche. Il gruppo OH costituisce un sito in cui possono avvenire molte reazioni.
Dal punto di vista della loro struttura chimica, gli alcoli sono classificati in primari, secondari o terziari in funzione del numero di gruppi alchilici legati all'atomo di carbonio cui è legato il gruppo -OH. Tale classificazione ha effetto anche sulla reattività chimica dell'alcol stesso.
Storia
[modifica | modifica wikitesto]La natura infiammabile delle esalazioni del vino era già nota agli antichi filosofi naturali come Aristotele, Teofrasto e Plinio il Vecchio[1]. Tuttavia, ciò non portò immediatamente all'isolamento dell'alcol, nonostante lo sviluppo di tecniche di distillazione più avanzate nel secondo e terzo secolo in Egitto.[2] Un'importante, scoperta, attestata per la prima volta in uno dei testi attribuiti a Jābir ibn Ḥayyān nel nono secolo, fu che aggiungendo sale al vino in ebollizione, che aumenta la sua volatilità relativa, la infiammabilità dei vapori risultanti può essere potenziata.[3] La distillazione del vino è attestata in opere arabe attribuite ad al-Kindī e ad al-Fārābī, e nel ventottesimo libro del Kitāb al-Taṣrīf di al-Zahrāwī. Nel dodicesimo secolo, ricette per la produzione di aqua ardens (acqua bruciante, cioè alcol) attraverso la distillazione del vino con sale cominciarono a comparire in vari testi latini, e alla fine del tredicesimo secolo era diventata una sostanza ampiamente conosciuta tra i chimici dell'Europa occidentale.[4]
Le opere di Taddeo Alderotti descrivono un metodo per concentrare l'alcol che comporta la distillazione frazionata ripetuta attraverso un alambicco raffreddato ad acqua, mediante il quale si poteva ottenere una purezza dell'alcol del 90%.[5] Le proprietà medicinali dell'etanolo furono studiate da Arnaldo da Villanova e da Giovanni di Rupescissa, quest'ultimo lo considerava una sostanza conservatrice della vita in grado di prevenire tutte le malattie (l'aqua vitae o "acqua della vita", anche chiamata da Giovanni la quintessenza del vino).[6]
Nomenclatura
[modifica | modifica wikitesto]Etimologia
[modifica | modifica wikitesto]La parola "alcol" deriva dall'arabo kohl, una polvere usata come eye-liner,[7] termine che deriva in ultima analisi dall'accadico 𒎎𒋆𒁉𒍣𒁕 (guḫlum), che significa stibnite o antimonio.[8]
Come i suoi antecedenti in arabo e nelle lingue più antiche, il termine alcol era originariamente usato per la polvere finissima prodotta dalla sublimazione della stibnite per formare il trisolfuro di antimonio; era considerato l'essenza o "spirito" di questo minerale. Veniva utilizzato come antisettico, eyeliner e cosmetico.Sia Paracelso che Libavius usarono il termine alcol per indicare una polvere fine, quest'ultimo riferendosi a un alcol derivato dall'antimonio, mentre Paracelso per indicare un liquido volatile: alcool o alcool vini ricorre infatti spesso nei suoi scritti.[9] Bartolomew Traheron, nella sua traduzione di Giovanni da Vigo del 1543, introduce la parola come un termine usato dagli autori "barbari" per "polvere fine".[10]
In seguito il significato di alcol è stato esteso alle sostanze distillate in generale, per poi restringersi nuovamente all'etanolo, mentre "spirito" è divenuto sinonimo di liquore.[11]
Il Lexicon Chymicum del 1657, di William Johnson, parla di "antimonium sive stibium".[12] Per estensione, il termine si riferiva a qualsiasi fluido ottenuto per distillazione, compreso l'"alcol di vino", l'essenza distillata del vino. Libavius in Alchymia (1594) si riferisce a "vini alcohol vel vinum alcalisatum". Johnson (1657) interpreta l'alcol vini come "quando omnis superfluitas vini a vino separatur, ita ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat". Il significato della parola si restrinse allo "spirito di vino" (la sostanza chimica oggi nota come etanolo) nel XVIII secolo e fu esteso alla classe di sostanze denominate "alcoli" nella chimica moderna dopo il 1850.[10]
Il termine etanolo è stato inventato nel 1892, mescolando "etano" con la desinenza "-ol" di "alcol", che è stata generalizzata.[13] Il termine alcol, invece, si riferiva originariamente all'alcol primario etanolo (alcol etilico), usato come droga e principale alcol presente nelle bevande alcoliche.
Il suffisso -olo compare nella denominazione chimica dell'Unione internazionale di chimica pura e applicata (IUPAC) di tutte le sostanze in cui il gruppo ossidrile è il gruppo funzionale con la priorità più alta. Quando nel composto è presente un gruppo a priorità più alta, nella sua denominazione IUPAC viene utilizzato il prefisso idrossi-. Anche il suffisso -olo nei nomi non IUPAC (come paracetamolo o colesterolo) indica tipicamente che la sostanza è un alcol. Tuttavia, alcuni composti che contengono gruppi funzionali idrossilici hanno nomi che non includono il suffisso -ol o il prefisso idrossi-, ad esempio gli zuccheri glucosio e saccarosio.
IUPAC
[modifica | modifica wikitesto]La nomenclatura IUPAC degli alcoli segue regole simili a quella degli alcani, tuttavia occorre evidenziare alcune differenze:
- il nome che viene dato alla catena principale è simile a quanto previsto per l'idrocarburo corrispondente con la perdita dell'ultima vocale e l'aggiunta del suffisso -olo
- nel numerare la catena principale, il numero più basso possibile dovrà essere assegnato all'atomo di carbonio cui è legato il gruppo -OH, e non agli eventuali atomi di carbonio coinvolti in doppi e tripli legami.
Quando il gruppo -OH viene considerato un gruppo sostituente, prende il nome di "idrossi-".
le formule di struttura di 1-butanolo, 2-butanolo e 3-buten-2-olo
Tradizionale
[modifica | modifica wikitesto]La nomenclatura tradizionale prevede l'uso del termine "alcol" seguito dall'aggettivo corrispondente al gruppo cui è legato il gruppo -OH, anch'esso nominato secondo la nomenclatura tradizionale. Tale nomenclatura è ancora diffusa nel caso di alcoli semplici.
Alcuni esempi:
| IUPAC | tradizionale |
|---|---|
| metanolo | alcol metilico |
| etanolo | alcol etilico |
| 1-propanolo | alcol n-propilico[14] |
| 2-propanolo | alcol isopropilico |
| 2-propenolo | alcol allilico |
| 1-butanolo | alcol n-butilico[15] |
| 2-metil-1-propanolo | alcol isobutilico |
| 1-esadecanolo | alcol cetilico |
Descrizione
[modifica | modifica wikitesto]Una stima grossolana della miscibilità in acqua di un alcol può essere fatta dalla conoscenza della sua formula bruta: infatti sono in genere miscibili in acqua gli alcoli che contengono fino a 4 atomi di carbonio per ogni atomo di ossigeno nella loro struttura La miscibilità in acqua degli alcoli, nonché il loro elevato punto di ebollizione rispetto ad altre molecole organiche di simili dimensioni e strutture è spiegato tramite la formazione di legami a idrogeno tra l'idrogeno del gruppo -OH e l'ossigeno delle molecole vicine.
La miscibilità in acqua degli alcoli che contengono più di 6 atomi di carbonio è pressoché nulla, in quanto il legame idrogeno che si forma tra l'ossidrile dell'alcol e i dipoli dell'acqua diventa sempre meno influente in presenza di lunghe catene di atomi di carbonio (che costituiscono la parte apolare della molecola).
Gli alcoli si ottengono sia da fonti naturali sia per sintesi. Esempi comuni di alcoli sono il metanolo e l'etanolo. Quest'ultimo è l'alcol per antonomasia: ottenuto in natura dalla fermentazione degli zuccheri, è l'alcol contenuto nelle bevande alcoliche.
Il gruppo -OH conferisce a queste molecole organiche un carattere leggermente acido (pKa circa 15-18). La pKa varia a seconda dell'ordine dell'alcol, gli alcol primari, in soluzione acquosa, sono più acidi degli alcol secondari che a loro volta sono più acidi degli alcol terziari. Sebbene originariamente si affermasse che la conseguenza di questa differenza di acidità fosse da attribuire agli effetti induttivi elettron-donatori dei gruppi alchilici(che iniettando densità elettronica verso l'ossigeno, porterebbero ad una destabilizzazione della base coniugata rendendo l'acido corrispondente, cioè l'alcol, più debole), ora è noto che questo è dovuto agli effetti di solvatazione. In soluzione acquosa, in seguito alla dissociazione, l'anione alcossido è circondato da molecole d'acqua che con il loro carattere polare, lo stabilizzano. Più gruppi alchilici sono presenti, più l'effetto della solvatazione diminuisce a causa dell'ingombro sterico; questo destabilizza l'anione alcossido e causa la diminuzione di acidità.
In fase gassosa l'ordine di acidità è invertito, infatti un alcol terziario risulta più acido di un alcol secondario che risulta più acido di un alcol primario. Questo è dovuto agli effetti di polarizzazione. Sia in soluzione acquosa che in fase gassosa vi sono effetti di polarizzazione, ma, mentre in soluzione acquosa prevalgono gli effetti di solvatazione, in fase gassosa(dove c'è assenza di solvente polare) ,gli effetti di polarizzazione determinano totalmente il carattere acido dell'alcol. Quando l'alcol terziario perde un idrogeno in fase gassosa, la base coniugata risulta stabilizzata da effetti di polarizzazione dovuti all'effetto induttivo elettron-repulsore dell'ossigeno. Quest'ultimo, donando densità elettronica, provoca una distorsione dell'orbitale sigma di legame C-C che lega il carbonio centrale a ciascun gruppo alchilico, in questo modo la densità elettronica si distribuisce in modo asimmetrico verso i gruppi alchilici lasciando il carbonio con una accentuata lacuna elettronica. Questa lacuna elettronica aumenta il carattere elettronegativo del carbonio legato all'ossigeno. L'aumento di elettronegatività del carbonio fa sì che l'ossigeno venga privato ulteriormente di densità elettronica, questo stabilizza l'anione alcossido rendendo l'alcol corrispondente più acido. Minore è il numero di gruppi alchilici, minore sarà l'effetto di polarizzazione e minore sarà l'acidità dell'alcol.
Utilizzi
[modifica | modifica wikitesto]Gli alcoli hanno una lunga storia di svariati utilizzi. Per gli alcoli monoatomici semplici i seguenti sono gli alcoli industriali più importanti:[16]
- metanolo, principalmente per la produzione di formaldeide e come additivo per carburanti
- etanolo, principalmente per bevande alcoliche, come additivo per carburanti, solvente
- 1-propanolo, 1-butanolo e alcol isobutilico per l'uso come solventi e precursori di solventi
- Alcoli C6-C11 utilizzati come plastificanti, ad es. nel polivinilcloruro
- alcoli grassi (C12-C18), precursori dei detergenti
Il metanolo è l'alcol industriale più comune, con circa 12 milioni di tonnellate/anno prodotte nel 1980. La capacità combinata degli altri alcoli è circa la stessa, distribuita approssimativamente in modo equo.[16]
Tossicità
[modifica | modifica wikitesto]Con riferimento alla tossicità acuta, gli alcoli semplici hanno basse tossicità acute. Dosi di diversi millilitri sono tollerate. Per pentanoli, esanoli, ottanoli e alcoli più lunghi, la DL50 varia da 2 a 5 g/kg (ratti, via orale). L'etanolo è meno acutamente tossico. Tutti gli alcoli sono lievi irritanti cutanei.[16]
Il metabolismo del metanolo (e del glicole etilenico) è influenzato dalla presenza di etanolo, che ha una maggiore affinità per l'alcol deidrogenasi epatica. In questo modo, il metanolo sarà escreto intatto nelle urine.[17][18][19]
Ossidoriduzioni
[modifica | modifica wikitesto]Gli alcoli possono andare incontro a reazioni di ossidazione per formare nuovi composti chimici, a seconda della propria natura.
- Alcoli primari vengono ossidati ad aldeidi, e le stesse aldeidi prodotte possono essere ancora ossidate per generare acidi carbossilici.
Es: Propanolo —> Propanale —> Acido propanoico
- Alcoli secondari vengono ossidati a chetoni. Tali chetoni non possono più essere ossidati successivamente.
- Alcoli terziari non possono essere ossidati.
Tutti i processi di ossidazione sono reversibili tramite una riduzione del prodotto.
Tendenzialmente per i processi di ossidoriduzione degli alcoli viene utilizzato un NAD+ che si riduce a NADH.
Preparazione industriale
[modifica | modifica wikitesto]Il metanolo (o alcol metilico, o spirito di legno) veniva preparato per distillazione secca del legno, da cui il nome. Oggi si produce principalmente per idrogenazione catalitica dell'ossido di carbonio:
L'etanolo (o alcol etilico, o spirito di vino) viene prodotto per fermentazione degli zuccheri nelle bevande alcoliche, ma quello per uso industriale viene principalmente prodotto per idratazione dell'etene:
H+ CH2=CH2 + H2O → CH3-CH2-OH
L'1-propanolo (o alcol n-propilico), alcool alifatico derivato dal propano, è usato come solvente:
CH3-CH2-CH2-OH
Preparazioni per sintesi
[modifica | modifica wikitesto]- addizione di carbanioni ad aldeidi o chetoni.
- Come fonte di carbanioni si possono usare composti organometallici, ossia composti organici aventi un atomo di un metallo direttamente legato a un atomo di carbonio; un esempio è rappresentato dai reattivi di Grignard
R" R' | | R-C=O (chetone) + R"-Mg-X → R-C-OH oppure: R-C=O (aldeide) + R'-Mg-X → R-C-OH | | | | R' R' H H
- un altro carbanione utilizzabile è uno ione acetiluro
R"-C≡C | R-C=O + R"-C≡C-Na → R-C-OH | | R' R'
- Si possono usare riducenti chimici come il boroidruro di sodio o il litio alluminio idruro
H NaBH4 | R-C=O + o → R-C-OH | LiAlH4 | R' R'
- o ricorrere a una idrogenazione catalitica simile a quella degli alcheni
H | R-C=O + H2 [CAT] → R-C-OH | | R' R'
- Consiste in una reazione di disproporzionamento, in cui un'aldeide (priva di atomi di idrogeno in posizione α rispetto al gruppo aldeidico) subisce in parte un'ossidazione ad acido carbossilico e in parte una riduzione ad alcol; è catalizzata da basi forti
2 R-CHO → R-COOH + R-CH2OH
- una sua variante, detta reazione di Cannizzaro incrociata, sfrutta la maggiore ossidabilità della formaldeide, che si ossida ad acido formico riducendo un'altra aldeide ad alcol
R-CHO + HCHO → R-CH2OH + HCOOH
- idratazione di alcheni
- Gli alcheni sommano una molecola di acqua trasformandosi in alcoli in presenza di un acido, che funge da catalizzatore
HO H H+ | | R-C=C-H + H2O → R-C-C-H | | | | R H R H
- l'orientamento dell'addizione è secondo Markovnikov, ovvero tende a dare preferenzialmente un alcol secondario o terziario
- ossimercuriazione-demercuriazione
- Simile alla precedente, ne costituisce un'alternativa quando non è possibile operare in ambiente acido; prevede l'iniziale addizione di acetato di mercurio seguita immediatamente dalla rimozione del mercurio per trattamento con boroidruro di sodio; anche in questo caso l'orientamento è secondo Markovnikov
HO Hg+ HO H | | NaBH4 | | R-C=C-H + Hg++, H2O → R-C--C-H → R-C-C-H | | | | | | R H R H R H
- idroborazione-ossidazione
- Un altro metodo per convertire un alchene in alcol, in questo caso l'orientamento dell'addizione è anti-Markovnikov, ossia produce preferenzialmente alcoli primari; l'alchene somma una molecola diborano e viene subito successivamente ossidata con perossido di idrogeno
H BH2 H OH | | H2O2 | | R-C=C-H + BH3 → R-C-C-H → R-C-C-H | | | | | | R H R H R H
Reazioni tipiche
[modifica | modifica wikitesto]- Preparazione di alogenuri alchilici.
- Alcoli terziari:
CH3 CH3 | HX | CH3-C-OH → CH3-C-X + H2O | | CH3 CH3
- È una reazione di sostituzione nucleofila monomolecolare (SN1). È possibile che in questo processo si formi isobutene, formatosi in seguito a una reazione di eliminazione che compete con questa.
- Alcoli primari e secondari:
R-OH + SOCl2 → R-Cl + SO2 + HCl
- questa reazione con il cloruro di tionile si effettua in presenza di piridina o di un'altra ammina terziaria per neutralizzare l'acido cloridrico che si forma.
3R-OH + PBr3 → 3R-Br + H3PO3
- La reazione con il tribromuro di fosforo richiede, rispetto all'utilizzo di HBr, condizioni molto meno drastiche.
- Alcoli primari:
ox ox RCH2OH → RCHO → RCOOH
- Se si mette un ossidante generico (solitamente si predilige l'uso di ) si passa direttamente da alcol ad acido carbossilico; per fermare la reazione ad aldeide bisogna usare il piridinio clorocromato (PCC).
- Alcoli secondari:
R R \ ox \ CHOH → C=O / / R' R'
- Alcoli III: Non avviene in quanto non si può formare il doppio legame carbonio-ossigeno.
- Reazioni acido-base.
Gli alcoli hanno un carattere debolmente acido (metanolo ed etanolo circa come l'acqua, quelli con alto peso molecolare ancora meno) e quindi non reagiscono con le basi deboli. È necessario quindi utilizzare basi molto forti come, ad esempio, sodio idruro e il metillitio.
ROH + NaH → RO-Na+ + H2
Questo effetto si ottiene anche utilizzando il sodio metallico, però in questo caso si tratta di una reazione di ossido-riduzione.
- Disidratazione
Si effettua riscaldando l'alcol in presenza di acido fosforico all'85% o acido solforico concentrato, che fungono da catalizzatori.
Gli alcoli primari sono i più difficili da disidratare e necessitano temperature fino a 180 °C, quelli secondari circa 140 °C e infine i terziari circa 50 °C.
calore R-CH-CH2-OH + H2SO4 -→ R-C=CH2 + H2O | | CH3 CH3
Note
[modifica | modifica wikitesto]- ^ Marcellin Berthelot e Octave V. Houdas, La Chimie au Moyen Âge, I–III, Paris, Imprimerie nationale, 1893. vol. I, p. 137.
- ^ Berthelot Houdas, 1893, vol. I, pp. 138–139.
- ^ Ahmad Y. al-Hassan, Alcohol and the Distillation of Wine in Arabic Sources from the 8th Century, in Studies in al-Kimya': Critical Issues in Latin and Arabic Alchemy and Chemistry, Hildesheim, Georg Olms Verlag, 2009, pp. 283–298. (same content also available on the author's website).
- ^ Robert P. Multhauf, The Origins of Chemistry, London, Oldbourne, 1966, ISBN 9782881245947. pp. 204–206.
- ^ Eric John Holmyard, Alchemy, Harmondsworth, Penguin Books, 1957, ISBN 978-0-486-26298-7. pp. 51–52.
- ^ Lawrence M. Principe, The Secrets of Alchemy, Chicago, The University of Chicago Press, 2013, ISBN 978-0226103792. pp. 69–71.
- ^ Douglas Harper, Alcohol, su Etymonline, MaoningTech. URL consultato il 17 maggio 2018.
- ^ Heinrich Robarts - University of Toronto, Akkadische Fremdwörter als Beweis für babylonischen Kultureinfluss, [S.l. : s.n., 1915. URL consultato il 20 febbraio 2024.
- ^ (EN) Hugh Chisholm (a cura di), Alcohol, in Enciclopedia Britannica, XI, Cambridge University Press, 1911.
- ^ a b alcohol, n., in OED Online, Oxford University Press, 15 novembre 2016.
- ^ H. Lohninger, Etymology of the Word "Alcohol", in VIAS Encyclopedia, 21 dicembre 2004. URL consultato il 17 maggio 2018.
- ^ William Johnson, Lexicon Chymicum, 1652.
- ^ Henry E. Armstrong, Contributions to an international system of nomenclature. The nomenclature of cycloids, in Proc. Chem. Soc., vol. 8, n. 114, 8 luglio 1892, p. 128, DOI:10.1039/PL8920800127.«As ol is indicative of an OH derivative, there seems no reason why the simple word acid should not connote carboxyl, and why al should not connote COH; the names ethanol ethanal and ethanoic acid or simply ethane acid would then stand for the OH, COH and COOH derivatives of ethane.»
- ^ si legga: normal-propilico
- ^ si legga: normal-butilico
- ^ a b c (EN) Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, DOI:10.1002/14356007.a01_279..
- ^ Schep LJ, Slaughter RJ, Vale JA, Beasley DM, A seaman with blindness and confusion, in BMJ, vol. 339, 30 settembre 2009, pp. b3929, DOI:10.1136/bmj.b3929, PMID 19793790.
- ^ HE Zimmerman, KK Burkhart e JW Donovan, Ethylene glycol and methanol poisoning: diagnosis and treatment, in Journal of Emergency Nursing, vol. 25, n. 2, 1999, pp. 116–20, DOI:10.1016/S0099-1767(99)70156-X, PMID 10097201.
- ^ S Lobert, Ethanol, isopropanol, methanol, and ethylene glycol poisoning, in Critical Care Nurse, vol. 20, n. 6, 2000, pp. 41–7, DOI:10.4037/ccn2000.20.6.41, PMID 11878258.
Bibliografia
[modifica | modifica wikitesto]- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 53-55, ISBN 88-08-09414-6.
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 193-216, ISBN 3-527-30578-5.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «alcoli»
Wikizionario contiene il lemma di dizionario «alcoli» Wikimedia Commons contiene immagini o altri file sugli alcoli
Wikimedia Commons contiene immagini o altri file sugli alcoli
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Leroy G. Wade, alcohol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Alcoli, su salvelocs.it. URL consultato il 10 agosto 2008 (archiviato dall'url originale il 19 dicembre 2008).
- Esperienze in laboratorio - Gli alcoli, su itchiavari.org.
- Esercizi svolti sulla Nomenclatura degli alcoli, su mnemochimica.it.
- (EN) IUPAC Gold Book, "alcohols", su goldbook.iupac.org.
| Controllo di autorità | Thesaurus BNCF 2055 · LCCN (EN) sh85003314 · GND (DE) 4141899-2 · BNF (FR) cb11965827j (data) · J9U (EN, HE) 987007293065705171 · NDL (EN, JA) 00560350 |
|---|


 French
French Deutsch
Deutsch
