Бис-(2-хлорэтил)этиламин — Википедия
| Бис-(2-хлорэтил)этиламин | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | C6H13Cl2N | ||
| Физические свойства | |||
| Молярная масса | 170,08 г/моль | ||
| Плотность | 1,0861 г/мл (при +20 °C) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −3,4 ± 0,1 °C[1] | ||
| • кипения | 194 ± 1 °C[1] | ||
| Давление пара | 0,25 ± 0,01 мм рт.ст.[1] | ||
| Классификация | |||
| Рег. номер CAS | 538-07-8 | ||
| PubChem | 10848 | ||
| SMILES | |||
| InChI | |||
| RTECS | 10391 | ||
| Номер ООН | 2810 | ||
| ChemSpider | 10391 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
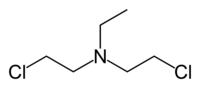
Бис(2-хлорэтил)этиламин, известный также как Газ HN1, Вещество HN1, Nitrogen mustard HN1 — это хлорорганическое соединение, простейшее производное бис-β-хлорэтиламина с химической формулой C2H5N(CH2CH2Cl)2. Часто называемый просто HN1, он является мощнейшим боевым отравляющим веществом кожно-нарывного и раздражающего действия, и является азотистым ипритом, боевым отравляющим веществом ("газом"), изначально планировавшимся к применению в военных целях, в качестве компонента химического оружия. Первоначально HN1 был разработан в 1920-х и 1930-х годах с целью выведения бородавок на коже, но позже стал применяться в военных целях. Вследствие возможности его применения в военных целях, его производство и применение строго ограничивается и регулируется согласно Международной Конвенции о запрещении химического оружия.
При нормальных условиях «газ HN1», на самом деле, вовсе не газообразный. Он представляет собой маслянистую, вязкую жидкость от бесцветного до бледно-жёлтого цвета (чистый HN1 бесцветен, цвет обусловлен примесями) и резким, неприятным, раздражающим, рыбным или тухлым запахом[2].
 |
 |
 |
Механизм действия
[править | править код]Все азотистые иприты алкилируют ДНК быстро делящихся клеток кожи. Однако для проявления алкилирующих свойств необходимо превращение (циклизация) в соответствующую соль азиридиния. Скорость этой реакции циклизации в биологически активную азиридиниевую соль сильно зависит от значения pH среды, так как протонированный амин не может циклизироваться. Ион азиридиния затем реагирует с водой в более медленной реакции гидролиза, при которой образуются неактивные соединения. При рН 8 (то есть при щелочной реакции среды) большая часть соединения практически сразу же превращается в азиридиниевую соль, с последующим медленным гидролизом в воде. При рH 4 (то есть при кислой реакции среды), напротив, циклизация в биологически активный азиридиний происходит медленно, а последующий гидролиз достаточно быстро. А поскольку в жидкостях и тканях организма реакция в норме слабо щелочная (pH ~ 7,4-7,7), то это обуславливает высокую скорость циклизации азотистых ипритов в водных средах организма в биологически активный азиридиний, быстрое проявление ими алкилирующего действия и последующий сравнительно медленный гидролиз.
См. также
[править | править код]- Хлорметин, известный также как «газ HN2», «вещество HN2», «nitrogen mustard HN2», мехлоретамин, мустин, эмбихин, мустарген
- Трис-(2-хлорэтил)амин, известный также как «газ HN3», «вещество HN3» и просто под кодовым названием «HN3»
- Производные бис-β-хлорэтиламина
Ссылки
[править | править код]- ↑ 1 2 3 http://www.cdc.gov/niosh/ershdb/emergencyresponsecard_29750010.html
- ↑ The Emergency Response Safety and Health Database: NITROGEN MUSTARD HN-1 Архивная копия от 30 октября 2013 на Wayback Machine. National Institute for Occupational Safety and Health. Accessed March 19, 2009.


 French
French Deutsch
Deutsch

