氢氧化钠 - 维基百科,自由的百科全书
此條目需要补充更多来源。 (2022年12月30日) |
| 氫氧化鈉 | |
|---|---|
 | |
 | |
| IUPAC名 Sodium hydroxide | |
| 别名 | 燒鹼、固碱、粒鹼、片鹼、苛性钠、火碱、液碱、苛性钠。哥士的[註 1] |
| 识别 | |
| CAS号 | 1310-73-2 |
| PubChem | 14798 |
| ChemSpider | 14114 |
| SMILES |
|
| InChI |
|
| InChIKey | HEMHJVSKTPXQMS-REWHXWOFAM |
| Gmelin | 68430 |
| UN编号 | 1823 |
| EINECS | 215-185-5 |
| ChEBI | 32145 |
| RTECS | WB4900000 |
| KEGG | D01169 |
| MeSH | Sodium+Hydroxide |
| 性质 | |
| 化学式 | NaOH |
| 摩尔质量 | 40.00 g·mol⁻¹ |
| 外观 | 白色不透明的蠟狀固体 |
| 密度 | 2.13 g/cm3 |
| 熔点 | 318 ℃ (591 K) |
| 沸点 | 1388 ℃ (1661 K) |
| 溶解性(水) | 111 g/100 ml (20 ℃) |
| 溶解性(甲醇) | 238 g/L |
| 溶解性(乙醇) | <139 g/L |
| 蒸氣壓 | <2.4 kPa (20 ℃) |
| pKb | -0.56 (NaOH(aq) ↔ Na+ + OH–) [1] |
| 折光度n D | 1.3576 |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R35-R37/38 |
| 安全术语 | S:S1/2, S26, S37/39, S45 |
| MSDS | External MSDS |
| 欧盟编号 | 011-002-00-6 |
GHS危险性符号 | |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 相关氢氧化物 | 氢氧化锂 氢氧化钾 氢氧化铷 氢氧化铯 氢氧化钫 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氫氧化鈉(sodium hydroxide)又称苛性钠(caustic soda),俗称碱液(lye)、片鹼、火碱、烧碱、液碱等,化學式為NaOH,是一種具有高腐蝕性的強鹼,一般為白色片狀或顆粒,能溶於水生成鹼性溶液,另也能溶解於甲醇及乙醇。此鹼性物具有潮解性,會吸收空氣中的水蒸氣,亦會吸取二氧化碳、二氧化硫等酸性氣體。
氫氧化鈉為常用的化學品之一。其應用廣泛,為很多工業過程的必需品:常用於製造木浆紙張、紡織品、肥皂[2]及其他清潔劑,另也用於煙氣脫硫與家用的水管疏通剂等。2004年全球總共製造了六千萬噸的氫氧化鈉,而總消耗量為五千一百萬噸。[3]
化学性質
[编辑]和酸反应
[编辑]氢氧化钠溶於水中會完全解离成钠离子與氢氧根离子,可以和酸进行酸鹼中和反应:
利用这一性质,可以制备一些酸的钠盐,如:
酸性很弱的苯酚也能与之反应:
和酸性氧化物反应
[编辑]氫氧化鈉在空氣中容易變質,就是因為和空氣中的二氧化碳发生了反应:
在溶液中发生,过量的二氧化碳会将碳酸钠转化为碳酸氫鈉(俗稱小蘇打):
由于玻璃製品中含有二氧化硅,氢氧化钠会与之反应生成硅酸钠,使得玻璃儀器中的活塞黏著於儀器上,無法再次使用。因此,存放氢氧化钠的细口瓶一般用橡胶塞封口。如果以玻璃容器长时间盛裝热的氫氧化鈉溶液,会造成玻璃容器损坏,甚至破裂的情況。
同样地,氢氧化钠也能和三氧化铬、五氧化二磷、三氧化二砷、二氧化硫、二氧化硒等其它酸性氧化物反应,生成它们的盐:
和两性氧化物及氢氧化物的反应
[编辑]氢氧化钠可以和两性氧化物或氢氧化物反应,生成羟基配合物,如:
和单质的反应
[编辑]硼、硅和两性金属(如铍、铝、锌等)和氢氧化钠反应,放出氢气:
英國在1986年有一油罐車誤裝載重量百分率濃度為25%的氫氧化鈉水溶液,氫氧化鈉便與油罐壁上的鋁產生化學變化,導致油罐因內部壓力過載而受損,反應方程式如下所示:
- (冷的情况下)
- (热的情况下)
和盐的反应
[编辑]过渡金属的盐类和一些主族金属的盐可以和氢氧化钠反应,生成更难溶的氢氧化物,或转化为可溶性的羟基配合物再次溶解。
以上反應的產物的顔色、溶解度等可被用來測試某種陽離子。
对于汞等氢氧化物不能稳定存在的物质来说,会生产氧化物或氧化物的水合物沉淀:
氢氧化钠可以将过渡金属的酰基离子转化为阴离子酸根(简单离子或多聚离子),如VO2+、UO22+等:
氫氧化鈉跟銨鹽產生反應,生成氨氣、水和相應的鈉鹽。此為銨離子的檢驗方法。
和其它无机物的反应
[编辑]和有机物的反应
[编辑]氢氧化钠可以将卤代烃、酯和酰卤水解。其醇溶液可以用于卤代烃的消去。例如:
另外,氫氧化鈉是一種鹼,可提供氫氧根離子,可催化羥醛縮合反應。首先,氫氧根離子會去質子化醛或酮,生成烯醇負離子和水,該烯醇負離子會進攻令一電中性的醛或酮,生成羥醛加成物負離子。然後加成物會質子化,在第一步所生成的水上拿掉質子,在生成最終的羥醛產物後,亦同時再生氫氧根離子(催化劑)。
由於氫氧化鈉可以提供氫氧根離子,所以亦可催化酮-烯醇互變異構[5]。這叫鹼催化酮-烯醇互變異構:

工业制法
[编辑]同时由于氢离子的氧化性大于钠离子,阴极生成氢气:
而钠离子与剩下的氢氧根离子结合生成氢氧化钠:
总反应方程式如下[6]:
19世紀以前,氫氧化鈉的製備通常會先以勒布朗制碱法生成前驅物碳酸钠,再通过高温煅烧,使得碳酸钠分解为氧化钠與二氧化碳,最後,將氧化钠溶於水中,便可製得氢氧化钠:
另外,也可利用複分解制備氫氧化鈉,碳酸鈉(俗稱為蘇打)與氫氧化鈣(俗稱為熟石灰)的反應方程式如下所示:[7]
安全性
[编辑]
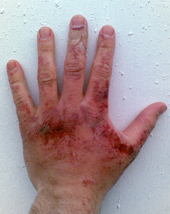
氢氧化钠固体或其溶液皆能灼伤皮肤,對无防护措施者可造成永久性伤害(如疤痕)。倘若讓氫氧化鈉直接接触眼睛的話,严重者甚至可造成失明。个人防护措施,諸如橡胶手套、防護衣與护目镜等便能大大降低接触氢氧化钠所带来的危险。
氢氧化钠溶于水中(如稀釋),抑或是與酸反應,都会放出大量的热量,可能导致灼伤或点燃易燃物(如有機溶劑)。除此之外,氢氧化钠能夠腐蚀一些金属(如铝)生成易燃的氢气,还能夠轻度腐蚀玻璃製品,應慎選儲存氫氧化鈉的容器材質。[8]
参看
[编辑]參考資料
[编辑]- ^ Sortierte Liste: pKb-Werte, nach Ordnungszahl sortiert. – Das Periodensystem online. [2019-01-15]. (原始内容存档于2018-11-16).
- ^ Morfit, Campbell. A treatise on chemistry applied to the manufacture of soap and candles. Parry and McMillan. 1856.
- ^ Cetin Kurt, Jürgen Bittner, Sodium Hydroxide, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a24_345.pub2
- ^ 乙酸乙酯 Ethyl acetate. 物竞数据库. [2021-01-19]. (原始内容存档于2021-02-06) (中文).
添加微量的酸或碱能促进水解反应。
- ^ 曾昭瓊. 《有机化学》第四版上册 第四版. 北京: 高等教育出版社. 2005. ISBN 7-04-013845-X.
- ^ 氢氧化钠 Sodium hydroxide. 物竞数据库. [2021-01-19]. (原始内容存档于2021-02-06) (中文).
将二次精制盐水电解,于阳极室生成氯气,阳极室盐水中的Na+通过离子膜进入阴极室与阴极室的0H生成氢氧化钠,H+直接在阴极上放电生成氢气
- ^ Chemistry:Precision and Design.Verne Biddle, Gregory Parker.A Beka Book, Inc.
- ^ aluminium_water_hydrogen.pdf (application/pdf Object) (PDF). www1.eere.energy.gov. 2008 [January 15, 2013]. (原始内容 (PDF)存档于2012年9月14日).


 French
French Deutsch
Deutsch











![{\displaystyle {\ce {2 NaOH + Al2O3 + 3 H2O -> 2 Na[Al(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/593acb5619abbc7012bdda9347bb76de24b275ab)
![{\displaystyle {\ce {NaOH + Al(OH)3 -> Na[Al(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f3924388e26c5f18ab43a779c9121a91ecebe87)

![{\displaystyle {\ce {2 Al + 2 NaOH + 6 H2O -> 2 Na[Al(OH)4] + 3 H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0fe42a6d77e52018aea7221e36ebeba1a5d3ca7)



![{\displaystyle {\ce {2 NaOH + Co(OH)2 -> Na2[Co(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d66331d9a2301674b7470b4687e3b0bf56152da)

![{\displaystyle {\ce {2 NaOH + Cu(OH)2 -> Na2[Cu(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bff3fa2102d54f269dc2b38fa9bfe1cb0e46222a)

![{\displaystyle {\ce {NaOH + Cr(OH)3 -> Na[Cr(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36b5ef083e815c436efda1eedacd96a5b2dbbe70)















