Калай – Уикипедия
| Калай | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 сиво-черен – α-калай (дясно) Блестящ и сребристо-бял – β-калай (ляво); сиво-черен – α-калай (дясно) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общи данни | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, символ, Z | Калай, Sn, 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група, период, блок | 14, 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическа серия | слаб метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронна конфигурация | [Kr] 4d10 5s2 5p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e- на енергийно ниво | 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS номер | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свойства на атома | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомна маса | 118,710 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомен радиус (изч.) | 145 (145) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен радиус | 139±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус на ван дер Ваалс | 217 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степен на окисление | 4, 3,[1] 2, 1,[2] −1, −2, −3, −4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксид | SnO2 (амфотерен); SnO (неутрален) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електроотрицателност (Скала на Полинг) | 1,96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Йонизационна енергия | I: 708,6 kJ/mol II: 1411,8 kJ/mol III: 2943 kJ/mol IV: 3930,3 kJ/mol (още) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физични свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Агрегатно състояние | твърдо вещество | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алотропи | β-калай (бял калай); α-калай (сив калай) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура (β-калай) | четириъгълна | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура (α-калай) | кубична осмостенна | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плътност | α: 5769 kg/m3 β: 7265 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура на топене | 505,08 K (232,08 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура на кипене | 2875 K (2602 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен обем | 16,239×10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Специф. топлина на топене | 7,03 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Специф. топлина на изпарение | 296,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорост на звука | 2730 m/s при 25 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Специф. топл. капацитет | 217 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Специф. електропроводимост | 9,1×106 S/m при 0 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Специф. ел. съпротивление | 0,115 Ω.mm2/m при 0 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлопроводимост | 66,8 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетизъм | α: диамагнитен β: парамагнитен [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на еластичност | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на срязване | 18 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на свиваемост | 58 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коефициент на Поасон | 0,36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твърдост по Бринел | 50 – 440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откритие | (≈3500 г. пр.н.е.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Най-дълготрайни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Калай в Общомедия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Калай е химичен елемент от четиринадесета група, пети период на периодичната таблица на Менделеев. Обозначава се със символа Sn (на латински: Stannum), а атомният му номер е 50. Отнася се към групата на леките метали. Калаят има две алотропни модификации: устойчив под 13,2 °C α-калай с кубична кристална решетка и устойчивият над 13,2 °C β-калай с тетрагонална кристална решетка. Има общо 10 стабилни изотопа. Поради много слабата си оксидация се използва да покрива други метали и да ги предпазва от корозия. Поради ниската си токсичност се използва при изработване на консервни кутии и други контейнери. Една от първите сплави, изработена от хората, е бронзът, който представлява сплав на мед и калай.
История
[редактиране | редактиране на кода]
Добивът и употребата на калай могат да бъдат проследени чак до началото на бронзовата ера – около 3000 г. пр.н.е., когато е наблюдавано, че мед с различни концентрации на други метали има различни характеристики.[4] Най-ранните бронзови предмети съдържат калай или арсен по-малко от 2% и по тази причина се счита, че са случайно попаднали в сплавта от медните руди.[5] Прибавянето на арсен или калай към медта я прави по-твърда и прави леенето и коването значително по-лесно. Това води до революционизиране на техниките за направа на метални предмети и извежда човечеството от медната до бронзовата епоха около 3000 пр.н.е.[5][6]
Първото доказателство за използване на калай при направата на бронз датира от 3000 г. пр.н.е. и идва от Близкия изток и Балканите.[5] Все още не е ясно къде за първи път е започнал да се добива калаят, тъй като мините са рядкост и са на големи разстояния. Открити са находки от този период и в долините на реките Тигър и Ефрат.[7] Използването на калая за изработката на предмети е причина за настъпването на бронзовата ера.[7] Първата мина в Европа изглежда е била на границата между Германия и Чехия около 2500 г. пр.н.е. и оттам калаят е пренесен до Балтийско и Средиземно море. Около 2000 г. пр.н.е. калаят е разпространен в цяла Европа.[5] Минното дело е в разцвета си по време на Римската империя – 300 г. пр.н.е. до 100 г.[8] Търсенето на калай става значително и търговията с него сред средиземноморските държави става една от най-важните.[9][10] По време на Средновековието Иберия и Германия загубват значението си в добива на калай, докато Корнуол и Девън започват да доминират европейския пазар.[8]
В Далечния изток, от Китай до Малайзия, калаят започва да се добива между 3-тото и 2-рото хилядолетие преди новата ера, като най-добре разработените залежи са в Юнан, но тяхната експлоатация започва около 700 г. пр.н.е., както свидетелстват запазени документи от династиите Хан, Сун и Тан.[11]
В останалите части на света добивът на калай започва значително по-късно. Така например в Африка народите банту добиват и използват калая между 11-и и 15 век,[5] в Америка добивът му започва около 1000 г., а в Австралия – около 17 век. В днешно време, след срива на пазара през октомври 1985 г., цената на калая става наполовина.[12]
Произход на името
[редактиране | редактиране на кода]Латинското име на елемента stannum е свързано със санскритска дума, означаваща „устойчив, здрав“, и първоначално се е отнасяла към сплав от олово и сребро, а по-късно – към друга, имитираща я сплав, съдържаща около 67% калай; някъде към 6 век с тази дума започва да се нарича само калаят.
В българския език думата е заемка от турски (kalay), като варианти на турската форма са разпространени в много азиатски езици и се предполага, че думата произлиза от името на град в Малака, откъдето е изнасян металът.[13]
Физични свойства
[редактиране | редактиране на кода]
Калаят е сребристобял, мек и ковък метал с кристална структура. Съществува в 2 алотропни модификации – белият (метален) калай при ниски температури се превръща в прах – сив калай. Когато парче калай се извие, се чува пукане, известно като „плачът на калая“.[14]
β-калай (метална форма), която съществува при стайна температура и по-високи температури, е мек и ковък, α-калай (неметална форма) се образува, когато се охлади под 13,2 °C и е крехък. Той има диамантена кристална структура, подобно на диамант, силиций или германий. α-калаят има само неметални свойства. Той е сив прахообразен материал, без обща употреба, само с няколко специализирани полупроводникови приложения.[14] α-калай и β-калай са по-известни като сив калай и бял калай съответно. Още две алотропни форми, γ и σ, съществуват при температура над 161 °C и налягане над няколко GPa.[15] Макар α-β трансформацията да става при температура 13,2 °C, примеси (напр. Al, Zn и т.н.), снижават температурата на прехода под 0 °C и при добавянето на Sb или Bi преобразуването може изобщо да не се прояви, което повишава издръжливостта на калая.[16]
Това преобразуване е известно като калаена болест или калаена чума. То представлява особен проблем в северната част на Европа през 18 век, когато тръбите на органи от калаена сплав понякога се повреждат по време на дълги студени зими. Някои източници също твърдят, че по времето на Наполеон и Руската кампания от 1812 г., температурите стават ниски и е толкова студено, че калаените копчетата на войнишките униформи се разпадат постепенно, което допринася за разгрома на Великата армия.[17]
Търговският калай (99,8%) устоява на тези трансформации поради действието на малки количества от бисмут, антимон, олово, сребро и други примеси. Сплавни елементи като мед, антимон, бисмут, кадмий и сребро увеличават твърдостта на калая, който, като правило, обикновено доста лесно образува твърди, крехки интерметални фази, които често са нежелани.
Температурата му на топене е приета за фиксирана точка по Международната температурна ска̀ла ITS-90, използвана като калибровъчен стандарт за термометри.[7]
Изотопи
[редактиране | редактиране на кода]Калаят е елемент с най-голям брой стабилни изотопи – десет, като те включват всички с атомните маси между 112 и 124, с изключение на 113, 121 и 123. От тях най-разпространените са 120Sn (почти една трета от всичкия калай), 118Sn и 116Sn, а най-слабо разпространеният е 115Sn. Калаят, с трите си най-разпространени изотопа 115Sn, 117Sn и 119Sn, е сред най-лесните за откриване и анализиране елементи с помощта на ЯМР (ядрен магнитен резонанс) спектроскопия.[18] Стабилните му изотопи имат следното съотношение на Земята и процес на синтезиране в звездите:[7]
Този голям брой стабилни изотопи се смята за пряк резултат от факта, че калаят има атомно число 50, което се счита за „магическо число“ в ядрената физика. Има още 28 допълнителни известни нестабилни изотопи, които включват всички останали с атомни маси между 99 и 137. Почти всички радиоактивни изотопи имат период на полуразпад по-малък от една година.[19]
Изотопът 129Sn има мьосбауерово гама ниво е енергия 23,871 keV, даващо възможност да се изучава структурата на калаените химични съединения чрез гама-спектроскопия и провеждането на научни експерименти.[7]
Химични свойства
[редактиране | редактиране на кода]Калаят е химичен елемент, член на 14-а група, под номер 50 и химичен знак Sn. Има атомно тегло 118,710.[7] Електронната конфигурация на последните два електронни слоя е 4s24p65s25p2. Благодарение на четирите си електрона във външната електронна обвивка, калаят образува стабилни съединения от втора и четвърта валентност. Той е по-реактивен от германия. Реагира лесно с хлор и бром.[20] При висока температура реагира с водни пари:
.
От разредените киселини му действа само азотната:[20]
.
При реакция с концентрирана HNO3 калаят се окислява до четвърта степен, при което се получава трудно разтворима бяла утайка от β-калаена киселина:[20]
.
В алкална среда на горещо оксиление също се стига до четвърта степен:[20]
.
Неорганични съединения
[редактиране | редактиране на кода]Химически калаят е класифициран като металоид, защото химичните му свойства попадат между метални и неметални, подобно на силиция и германия.
Калаят взаимодейства лесно със силни киселини и алкални метали, но не атакува забележимо неутрални разтвори.[7] Хлорът, бромът и йодът реагират с калая, но флуорът взаимодейства слабо с него при стайна температура.[7] Калаят образува диоксид (SnO2), а с водорода –летлив тетрахидрид H4Sn.[7] С хлора образува дихлопид (SnCl2) и тертахлорид (SnCl4). С алкалните метали образува станати (SnO3-).[7]
Устойчив е на корозия от всякакъв вид вода – морска, питейна, дестилирана, но може да бъде атакуван с киселини и някои киселинни соли. Той може да бъде полиран до съвършенство и се използва като защитно покритие на други метали, за да се предотврати корозия и други химични реакции. Калаят може да играе роля на катализатор при наличие на кислород в разтвора.[14]
Органични съединения
[редактиране | редактиране на кода]В органичните съединения калаят обикновено е от +4 степен на окисление.[7] Известни са четири серии органични калаени съединения: R4Sn, R3SnX, R2SnX2 и RSnX3.[7] R обикновено е бутилова, октилова и фенилова група, а Х най-често е флуор, хлор, оксид, хидроксид или карбоксилат.[7] Първото органично съединение на калая е диетилкалаеният дийодид Sn(C2H5)2I2, синтезиран през 1849 г. от Едуард Франкланд.[7]
Химичните, физичните и биологичните свойства на неорганичните калаени съединения силно се отличават от органичните му съединения.[7] Оформено е мнението, че неограничните съединения не са високо токсични, тъй като не се абсорбират добре от тъканите.[7] Известни са около 250 органични калаени съединения, като малка част от тях се произвеждат, но само около 36 се смятат за токсични.[7]
Интерес към калаените съединения е проявен през Първата световна война като средство против гъбични инфекции.[7] На основата на (C6H5)3SnOOCH3 е разработен ефективен препарат против гъбични заболявания при картофите и цвеклото.[7] Препаратът също стимулира растежа.[7] За борба с гъбичните образувания в съоръженията от хартиената промишленост се използва трибутилкалаен хидроксид.[7]
Разпространение и добив
[редактиране | редактиране на кода]

Калаят е 49-ият по разпространение елемент в земната кора, като представлява 2 ppm (сравнено със 75 ppm за цинка, 50 ppm за медта, и 14 ppm за оловото).[21] Калаят не се намира в природата като чист елемент и се добива от различни руди. От минералите, които съдържат калай, най-важният е каситеритът, калаен камък[7] (SnO2), като малки количества се получават и от станин. Минералите с калай се свързват обикновено с различни гранитни скали, съдържащи около 1% калаен оксид.[22] В свободно състояние се намира в някои златоносни пясъци.[20] Минералът каситерит съдържа около 78% калай. В процеса на производство рудата се разбива на частици със средни размери от порядъка на 10 mm, след което каситеритът, поради по-голямата си плътност, се отделя чрез вибрационно-гравитационен метод от скалната маса. Като допълнение се използва флотационен метод за обогатяване на рудата. По този начин се постига повишаване на съдържанието на калая до 40 – 70%. След това се извършва окисляване за премахване на примесите на сяра и арсен. Полученият концентрат на калаената руда се претопява в пещи. Калаят се възстановява до свободно състояние с помощта на слоеве дървени въглища, редуващи се със слоеве руда. Реакцията е:
За получаването на тази реакция се използват електросъпротивителни пещи или отражателни (пламъчни) пещи.
| Държава | Резерви |
|---|---|
| 1 500 000 | |
| 250 000 | |
| 310 000 | |
| 800 000 | |
| 590 000 | |
| 400 000 | |
| 350 000 | |
| 180 000 | |
| 170 000 | |
| Други | 180 000 |
| Общо | 4 800 000 |
Поради голямото специфично тегло на калаения диоксид, около 80% от добиваната руда е от находища, които са вторични наносни, намиращи се по посока на потока на водите, идващи от първичните рудни жили и получени вследствие на размиването им и разположени в долините или морето. Част от тях са находища в алувийни почви. Едни от най-икономичните методи на добив е драгиране, хидроразбиване или открити мини. Използвани са и методи на промиване, подобно на добива на злато.
При добива на каситерит в световен мащаб над 50% от рудата се получава от малки мини (за сравнение със златото, където са 10%). Съдържащата калай руда каситерит е един от минералите от така наречените конфликтни минерали, подобно на така наречените кървави диаманти, злато и други. Добивът на рудата в Конго се извършва под контрола на различни военни групировки, които системно нарушават човешките права в с робски труд, използване на детски труд, и безконтролно експлоатиране на добива с цел финансиране на военните групировки. Износът се оценява на 15 хил. тона годишно. Износът на рудата от този регион трябва да бъде контролиран от различни правителствени и неправителствени организации с цел премахване на конфликта и подлежи на официално обявяване.
Особено чист калай с полупроводникова чистота се получава чрез електрохимично рафиниране или чрез метода зонно топене.[23]
Около 253 000 тона калай е произведен от руда през 2011 година, главно от Китай (110 000 t), Индонезия (51 000 t), Перу (34 600 t), Боливия (20 700 t) и Бразилия (12 000 t). Очакванията за производството варират с динамиката на икономическото развитие и развитието на технологиите за добив на калай. При днешните тенденции на развитие на потреблението се очаква добива на нов калай да стигне за следващите 40 години.
Един все по-перспективен и важен източник на чист калай е рециклирането на отпадъчно оборудване. САЩ, които не са добивали калаена руда от 1993 година, са най-големият производител на рециклиран калай в света, като са получили през 2006 година 14 000 тона от рециклиране.[24]
Има информация за нови находища в южната част на Монголия,[25] и през 2009, нови находища са открити в Колумбия.[26]
По-маловажни са два комплексни сулфидни минерала – станит, Cu2FeSnS4 и цилиндрит, PbSn4FeSb2S14.[7] Срещат се главно в залежите на Боливия, често смесени с други метали, напр. сребро.[7]
Приложение
[редактиране | редактиране на кода]Традиционно използване
[редактиране | редактиране на кода]
- В миналото калаят е използван широко за производство на тръбите на органите. Обикновено той се използва за целта като сплав с оловото, наречена още метал за органи. Произвеждани са различни домашни прибори и съдове, както и фигури от калай. От средновековието леярите на калай са специална професия, която и днес може да се срещне, но много по-рядко. В миналото е била популярна и професията на почиствач на предмети от калай. За почистването им в миналото е използват студен извлек от полски хвощ, които поради тази причина е наричан от хората калаена билка.
- В България в миналото калаят се използва основно за калайдисване на съдове, изработени от мед – горещо покритие на медни съдове за готвене и съхранение като тави, медни котли, тигани, джезвета, мангали и други. Обикновено това се извършва от така наречените калайджии. Много често те са от калдарашите.
- Изработка на станиол. Той се произвежда още от 17 век от чиста калаена ламарина чрез леене, валцоване и изковаване. В миналото е произвеждан с дебелина от 0,1 mm, а по-късно до 0,02 mm. Използван е за опаковка на хранителни продукти, както и за украса, но постепенно е заменен от алуминиево фолио.
- Композиционната сплав бабит се използва широко в миналото. Представлява антифрикционна леснотопима сплав. Може да е оловна, калаена или оловно-калаена, легирана с антимон, мед, никел, кадмий, телур, калций, натрий и др. Приложение в миналото – за плъзгащи лагери.
- Революция в книгопечатането прави Йоханес Гутенберг през 15-век. Една основна новост при Гутенберг е, че производството на печатарските букви става с метода на отливане от сплав на калай, олово, антимон и малко бисмут. Съвременните методи на печатане не използват тази технология.
Съвременно използване
[редактиране | редактиране на кода]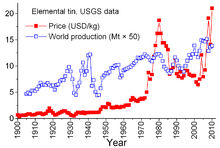
Годишно в света се изразходват около 360 000 тона калай. От тях в Европа и Америка около 35% се използват за припои, около 30% за бяла ламарина и около 30% за химикали, пигменти, сплави, за плоско стъкло и други. В световен мащаб над половината от калая се използва за спояване. Само в Азия годишно 150 000 тона калай се използват за припои.[27]
- Калаят се използва за производство на бяла ламарина – стоманена ламарина с дебелина от 0,1 до 0,5 mm с покритие от калай. Причината е в химическата му устойчивост и безопасност към хранителните продукти. В миналото калайдисването се е извършвало основно по горещ метод, а по-късно с използването на галванично покритие се постига по-тънко и икономически по-изгодно покритие. Тази ламарина се използва широко за производство на консервени кутии за хранителни продукти. На английски „tin“ (тин) се използва и за калай, и за консервна кутия.
- Другата основна област на широко използване е за спояване на електронни елементи. Поради опасността за здравето на хората и околната среда, трябва да се ограничи използването на оловото в електрониката, както и използването на кадмий и живак. Като заместител на съдържащите олово припои се използват сплави от групите Sn/Ag, Sn/Cu и Sn/Ag/Cu. Тези припои са по-трудни в използването и имат определени технически проблеми. Един от тях е по-високата температура на топене. Това може да доведе например до повреди на елементи, чувствителни към температурата. Освен това калаят не е устойчив при ниски температури (така наречена калаена чума) и образува кристални структури, наречени „калаени мустаци“ (на английски: Tin whiskers), които могат да направят късо съединение в електронните схеми. В промишлеността се използват два основни вида припои: със съдържание на олово и безоловни. В зависимост от приложението на електронните платки има различни примеси в припоите. Олово-съдържащи припои се допускат само за медицинско, военно и космическо оборудване поради по-голямата им надеждност. Като цяло поради забраната за използването на оловото, значението на калая като съставна част на припоите се увеличава все повече.
- В производството на флоатно стъкло се използва вана с разтопен калай, върху който се разлива разтопеното стъкло и след изстиване то се втвърдява и подлага на термообработка.
- Високопречистени кристали от калай могат да се използват за производство на електронни елементи.
- Изкуствените изотопи на калая 117Sn и 119Sn са изотопи на Мьосбауер и се използват в Мьосбауеровата спектроскопия (гама резонансна спектроскопия).
- Калаят е потенциално интересен материал за изработка на съвременните литиево-йонни батерии.
- Калаеният диоксид е абразивен материал, който се използва основно за финишна обработка на оптично стъкло.
- Представлява интерес за разработката на свръхпроводими материали. Интерметалното съединение на калая с ниобий, Nb3Sn има температура на свръхпроводимост 18,5 К.
- Калаят се използва в денталната медицина за производство на някои видове амалгама, използвана за запълване на зъбни кариеси.
- Под формата на прозрачна сплав на калаен оксид и индиев оксид се използва като прозрачен токопроводящ слой в индикатори от типа на течнокристални дисплеи.
- Калаеният дихлорид се използва за щамповане на памучни тъкани.[7]
Органични съединения на калая
[редактиране | редактиране на кода]Органичните съединения на калая са предмет на разработки като част от металоорганичната химия.
- Някои органични калаени съединения са относително отровни, със съответните проблеми и предимства. Те се използват като фунгициди, пестициди, алгациди, препарати за консервиране на дървесината, както и препарати за защита на подводни повърхности от обрастване с водорасли. Калаен трибутил е използван като добавка на боя за боядисване на кораби, за да предотврати нарастването на морски организми върху тях, докато се разбира, че е особено отровен за някои морски организми.[28] ЕС забранява използването на органични съединения на калая през 2003 година,[29] поради опасността на токсичността им върху живота в моретата (някои данни сочат биологичен ефект върху морски форми на живот при концентрация от 1 ng/L), което води до забрана от страна на Международната морска организация за използване в международен мащаб.[30]
- Съединения на калая се използват за стабилизатори в пластмасите от PVC. При липса на такива стабилизатори пластмасите от PVC много бързо стареят от въздействието на топлината, светлината и атмосферния кислород, предизвикващи крехкост и обезцветяване на пластмасата. Калаят отстранява нестабилните хлоридни йони (Cl−), които в противен случай ще предизвикат загуба на HCl от пластмасата.[31]
Опасности от калая
[редактиране | редактиране на кода]Не са известни отравяния с калай и неорганичните му съединения като оксиди и соли. Някои органични съединения на калая са почти толкова отровни, колкото цианидите.[32]
На работните места при работа с калай могат да се получат въздействия върху работника чрез вдишване, контакт с кожата и очите. Граничните стойности за допустими норми на въздействие през 8 часа работен ден са определени в България с Наредба 13 от 30 декември 2003 г.[33] Нормите за безпроблемна работна среда са 2 mg/m3 за неорганични съединения на калай и 0,1 mg/m3 за органични съединения.
Източници
[редактиране | редактиране на кода]- ↑ SnH3 // NIST Chemistry WebBook. National Institure of Standards and Technology. (на английски)
- ↑ HSn // NIST Chemistry WebBook. National Institute of Standards and Technology. (на английски)
- ↑ Lide, D. R. Magnetic susceptibility of the elements and inorganic compounds // CRC Handbook of Chemistry and Physics. 86th. Boca Raton (FL), CRC Press, 2005. ISBN 0-8493-0486-5. (на английски)
- ↑ The „Bronze Age tin mines in Central Asia // The Problem of Early Tin. Oxford, Archaeopress, 2003. ISBN 1841715646.
- ↑ а б в г д Penhallurick, R.D. Tin in Antiquity: its Mining and Trade Throughout the Ancient World with Particular Reference to Cornwall. London, The Institute of Metals, 1986. ISBN 0904357813.
- ↑ The development of the usage of tin and tin-bronze: some problems // The Search for Ancient Tin. Washington D.C., A seminar organized by Theodore A. Wertime and held at the Smithsonian Institution and the National Bureau of Standards, Washington D.C. March 14 – 15, 1977, 1979.
- ↑ а б в г д е ж з и к л м н о п р с т у ф х ц ч ш щ Лефтеров, Димитър. Химичните елементи и техните изотопи. Издателство на БАН „Проф. Марин Дринов“, 2015. ISBN 978-954-322-831-7. с. 94 – 98.
- ↑ а б Gerrard, S. The Early British Tin Industry. Stroud, Tempus Publishing, 2000. ISBN 0752414526.
- ↑ The problem of early tin from the point of view of Nuragic Sardinia // The Problem of Early Tin. Oxford, Archaeopress, 2003. ISBN 1841715646.
- ↑ The cargo of the Uluburun ship and evidence for trade with the Aegean and beyond // Italy and Cyprus in Antiquity: 1500 – 450 BC. Nicosia, The Costakis and Leto Severis Foundation, 2001. ISBN 9963810233.
- ↑ Murowchick, R.E. The Ancient Bronze Metallurgy of Yunnan and its Environs: Development and Implications. Michigan, Ann Arbour, 1991.
- ↑ Thoburn, John T. Tin in the World Economy. Edinburgh University Press, 1994. ISBN 0748605169.
- ↑ Георгиев, В. И. (ред.). Български етимологичен речник. Том II. София, Издателство на Българската академия на науките, 1979. с. 158.
- ↑ а б в Holleman, Arnold F. et al. Tin // Lehrbuch der Anorganischen Chemie. 91 – 100. Walter de Gruyter, 1985. ISBN 3110075113. S. 793 – 800. (на немски)
- ↑ Molodets, A. M. и др. Thermodynamic Potentials, Diagram of State, and Phase Transitions of Tin on Shock Compression // High Temperature 38 (5). 2000. DOI:10.1007/BF02755923. с. 715 – 721.
- ↑ Schwartz, Mel. Tin and Alloys, Properties // Encyclopedia of Materials, Parts and Finishes. 2nd. CRC Press, 2002. ISBN 1566766613.
- ↑ Le Coureur, Penny и др. Napoleon's Buttons: 17 Molecules that Changed History. New York, Penguin Group USA, 2004.
- ↑ Interactive NMR Frequency Map // Архивиран от оригинала на 2009-01-14. Посетен на 5 май 2009.
- ↑ Walker, Phil. Doubly Magic Discovery of Tin-100 // Physics World 7 (June). 1994.
- ↑ а б в г д Киркова, Елена. Химия на елементите и техните съединения. София, Университетско издателство „Св. Климент Охридски“, 2013. ISBN 978-954-07-3504-7. с. 235 – 250.
- ↑ Emsley 2001, с. 124, 231, 449 and 503
- ↑ Tin: From Ore to Ingot // International Tin Research Institute, 1991. Архивиран от оригинала на 2009-03-22. Посетен на 21 март 2009.
- ↑ Большаков К. А., Федоров П. И. Химия и технология малых металлов. М., 1984.
- ↑ Carlin, Jr., James F. Tin: Statistics and Information (PDF) // United States Geological Survey. Посетен на 23 ноември 2008.
- ↑ Kovalenko, V. I. и др. Endogenous rare metal ore formations and rare metal metallogeny of Mongolia // Economic Geology 90 (3). 1995. DOI:10.2113/gsecongeo.90.3.520. с. 520. Архивиран от оригинала на 2008-09-05.
- ↑ Seminole Group Colombia Discovers High Grade Tin Ore in the Amazon Jungle // FreePR101 PressRelease. Архивиран от оригинала на 2014-08-26. Посетен на 2017-04-27.
- ↑ Tin Use Survey 2007 // ITRI. Архивиран от оригинала на 2008-12-07. Посетен на 21 ноември 2008.
- ↑ Eisler, Ronald. Tin Hazards To Fish, Wildlife, and Invertebrates: A Synoptic Review (PDF) // U.S. Fish and Wildlife Service Patuxent Wildlife Research Center. Архивиран от оригинала на 2012-10-07. Посетен на 2017-04-30.
- ↑ Regulation (EC) No 782/2003 of the European Parliament and of the Council of 14 April 2003 on the prohibition of organotin compounds on ships // Посетен на 5 май 2009.
- ↑ Fouling on Shipping // Biofouling. Oxford, Blackwell, 2008. ISBN 978-1-4051-6926-4. с. 227.
- ↑ Atkins, Peter. Inorganic chemistry. 4th. W.H. Freeman, 2006. ISBN 0-7167-4878-9. с. 343, 345.
- ↑ Graf, G. G. (2000) „Tin, Tin Alloys, and Tin Compounds“ in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH, Weinheim DOI:10.1002/14356007.a27_049
- ↑ Наредба № 13 от 30 декември 2003 г. За защита на работещите от рискове, свързани с експозиция на химични агенти при работа. В сила от 31 януари 2005 г. Издадена от Министерството на труда и социалната политика и Министерство на здравеопазването
Периодична система на елементите | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||


 French
French Deutsch
Deutsch
![{\displaystyle {\ce {Sn + 2H2O(g) ->[{t}] SnO2 + 2H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a07ba3afea20b0d5fae64af0d0536dd3d8158b8)


![{\displaystyle {\ce {Sn + 4kHCl -> H2[SnCl4] + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7e78b89c23d7f0e12af1605af2296d6a43261da)

![{\displaystyle {\ce {Sn + 2KOH + 4H2O ->[{t}] K2[Sn(OH)6] + 2H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/231f1fb374b63a7df0bc32fabfb88e3268ad9b1e)
