Плутоний – Уикипедия
| Плутоний | ||||||||||||||||||||||||||||||||||||||||||||||||
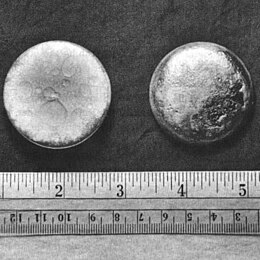 Сребристо-бял до сребристо-сив метал | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Общи данни | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, символ, Z | Плутоний, Pu, 94 | |||||||||||||||||||||||||||||||||||||||||||||||
| Група, период, блок | –, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||
| Химическа серия | актинид | |||||||||||||||||||||||||||||||||||||||||||||||
| Електронна конфигурация | [Rn] 5f6 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||
| e- на енергийно ниво | 2, 8, 18, 32, 24, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||
| CAS номер | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Свойства на атома | ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомна маса | [244] u | |||||||||||||||||||||||||||||||||||||||||||||||
| Атомен радиус | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен радиус | 187±1 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Степен на окисление | 8, 7, 6, 5, 4, 3, 2, 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Оксид | PuO2 (амфотерен) | |||||||||||||||||||||||||||||||||||||||||||||||
| Електроотрицателност (Скала на Полинг) | 1,28 | |||||||||||||||||||||||||||||||||||||||||||||||
| Йонизационна енергия | I: 584,7 kJ/mol II: 1128 kJ/mol III: 2084 kJ/mol IV: 3338 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Физични свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Агрегатно състояние | твърдо вещество | |||||||||||||||||||||||||||||||||||||||||||||||
| Алотропи | α-Pu, β-Pu, γ-Pu, δ-Pu, δ'-Pu и ε-Pu [1][2] | |||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура (α- и β-плутоний) [1][2] | моноклинна | |||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура (δ- и ε-плутоний) [1][2] | кубична | |||||||||||||||||||||||||||||||||||||||||||||||
| Плътност | 19816 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Температура на топене | 912,5 K (639,5 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Температура на кипене | 3505 K (3232 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Моларен обем | 12,31×10-6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Специф. топлина на топене | 2,82 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Специф. топлина на изпарение | 333,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Скорост на звука | 2260 m/s | |||||||||||||||||||||||||||||||||||||||||||||||
| Специф. електропроводимост | 6,7×105 S/m | |||||||||||||||||||||||||||||||||||||||||||||||
| Специф. ел. съпротивление | 1,46 Ω.mm2/m | |||||||||||||||||||||||||||||||||||||||||||||||
| Топлопроводимост | 6,74 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||
| Магнетизъм | парамагнитен[3] | |||||||||||||||||||||||||||||||||||||||||||||||
| Модул на еластичност | 96 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Модул на срязване | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Коефициент на Поасон | 0,21 | |||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||
| Наименуван | на планетата Плутон | |||||||||||||||||||||||||||||||||||||||||||||||
| Откритие | Глен Сиборг, Артур Уол, Джоузеф Кенеди, Едуин Макмилан (1940 – 1941 г.) | |||||||||||||||||||||||||||||||||||||||||||||||
| Най-дълготрайни изотопи | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Плутоний в Общомедия | ||||||||||||||||||||||||||||||||||||||||||||||||
Плутоний (Pu) е наименованието на химичния елемент с номер 94 в периодичната таблица.
Плутоният е радиоактивен трансуранов елемент с метален характер и принадлежи към групата на актинидите. При стайна температура е сивкав метал с висока плътност и характерен блясък, който бързо губи при контакт с атмосферата поради оксиление. Плътността му е 19,8 g/cm³, има температура на топене от 640 °С и кипи при 3228 °С. В природата се среща в минимални количества като продукт на естествени ядрени реакции, протичащи в урановите руди. Съществуващите естествени количества са от порядъка на няколко атома на няколко тона уранова руда. Почти всички съвременни ядрени оръжия го използват като основен работен материал.
Открит е през 1940 година от американския учен Глен Сиборг чрез облъчване на уран с деутерони. Практически най-значимият му изотоп е Pu-239, с период на полуразпад от 24 360 години. Pu-239 се получава в ядрените реактори от U-238 при захват на неутрон и се разпада чрез излъчване на алфа-частица или чрез спонтанно делене.
Друг изотоп е Pu-244, който има ограничено практическо приложение поради краткия си живот.
История
[редактиране | редактиране на кода]
През 1934 Енрико Ферми и екип от учени от университета в Рим съобщават, че са открили елемент 94. Ферми нарича този елемент hesperium и го споменава в своята Нобелова лекция през 1938 г. Пробата всъщност представлява смес от барий, криптон и други елементи, но тогава това все още не е било известно. Ядрено делене е открито в Германия през 1939 г. от Фриц Щрасман и Ото Хан. Механизмът на делене тогава теоретично е бил обяснен от Лиза Майтнер и Ото Фриш.
Плутоний (по-специално, плутоний-238) за пръв път е произведен и изолиран на 14 декември 1940 г., и химически идентифициран на 23 февруари 1941 г. от Глен Сиборг, Едуин Макмилан, Джоузеф Кенеди и Артър Уол в радиационната лаборатория Бъркли в Университета на Калифорния, Бъркли.
Употреба
[редактиране | редактиране на кода]Производство за проекта „Манхатън“
[редактиране | редактиране на кода]По време на Втората световна война правителството на САЩ създава проекта Манхатън за разработване на атомна бомба. Основните изследователски и производствени обекти на проекта са: съоръжение за производство на плутоний това, което сега е на обекта Ханфорд; съоръжения за обогатяване на уран в Оук Ридж, Тенеси; лаборатория за изследване и производство на оръжия, сега известна като Лосаламоска национална лаборатория.
Първият реактор, произвел плутоний-239, е графитният реактор Х-10, който е пуснат в употреба през 1943 г., а по-късно става Национална лаборатория „Оук Ридж“.
Атомни бомби „Тринити“ и „Дебелак“
[редактиране | редактиране на кода]Първият тест на атомна бомба с кодовото име „Тринити“, извършен на 16 юли 1945 г. близо до Аламогордо, Ню Мексико, използва плутоний като ядрен материал. Теглото на атомната бомба е 4 тона, а в ядрото си е имала 6,2 kg плутоний. Около 20% от плутония, използван в оръжието „Тринити“ претърпява разпад, в резултат на което се създава експлозия с енергия еквивалентна на приблизително 20 000 тона ТНТ. Подобна е и атомна бомба „Дебелакът“, пусната над Нагасаки, Япония, на 9 август 1945 г., убивайки 35 000 – 40 000 души (повечето от които са били индустриални работници) и унищожавайки 68 – 80% от военното производство в Нагасаки.
По време на Студената война
[редактиране | редактиране на кода]Големи запаси оръжия, използващи плутоний, са произведени по времето на Студената война от СССР и САЩ. В САЩ реакторите Ханфорд и Обект Савана Ривър са произвели 103 тона плутоний, а в СССР произведенят плутоний за военни цели възлиза на 170 тона. В днешни дни се произвеждат годишно по 20 тона плутоний, използващ се от електроцентралите. По предположения, днес запасите от плутоний са около 500 тона разделени между индустриалния и военния комплекс на страните по света.
Медицински експерименти
[редактиране | редактиране на кода]По време и след края на Втората световна война, учени, работещи по проекта Манхатън и други ядрени изследователски проекти са провеждали проучвания за ефектите на плутония върху животни и хора. Проучванията при животни са установили, че няколко милиграма плутоний за килограм тъкан е смъртоносна доза. В случая на хора, са инжектиране разтвори, обикновено съдържащи 5 μg плутоний в терминално болни пациенти смятани за неизлечимо болни, пациенти с продължителност на живота по-малко от десет години, възрастни пациенти или пациенти в хронично болестно състояние. Дозата е била намалена до 1 μg през юли 1945, след като проучванията открили, че начина, по който плутония се разпространява в костите е по-опасен от радиацията. Повечето от инжектираните с плутоний пациенти, според Айлийн Уелсом, оцелял след експеримента, казва „бяха бедни, безсилни и болни“. От 1945 до 1947 г., осемнадесет индивида са били инжектирани с плутоний без тяхното съгласие. Тестовете са били използвани за създаване на диагностичен стандарт, за да се определи усвояването на плутония в тялото и да се разработят стандарти за безопасност при работата с плутоний. Експериментът се е провеждал под надзора на Харолд Ходж. Други експерименти под назора на комисията по енергетиката на САЩ са продължили до средата на 1970 г.
Източници
[редактиране | редактиране на кода]- ↑ а б в Hecker 2000.
- ↑ а б в Baker 1983.
- ↑ Lide 2005.
- Използвана литература
- Hecker, Siegfried S. Plutonium and its alloys: from atoms to microstructure (PDF) // Los Alamos Science 26. 2000. p. 290 – 335. (на английски)
- Baker, Richard D. et al. Plutonium: A Wartime Nightmare but a Metallurgist's Dream // Los Alamos Science. Los Alamos National Laboratory, 1983. p. 148, 150 – 151. (на английски)
- Lide, D. R. Magnetic susceptibility of the elements and inorganic compounds // CRC Handbook of Chemistry and Physics. 86th. Boca Raton (FL), CRC Press, 2005. ISBN 0-8493-0486-5. (на английски)
| Тази страница частично или изцяло представлява превод на страницата Plutonium в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите. ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |
Периодична система на елементите | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||


 French
French Deutsch
Deutsch