Glucidi
I glucidi o glicidi (dal greco antico: γλυκύς?, glucús, "dolce"), chiamati anche carboidrati o saccaridi o zuccheri, sono dei composti chimici organici formati da atomi di carbonio, idrogeno e ossigeno.[1]
I glucidi hanno numerose funzioni biologiche, tra cui quella di fonte energetica e trasporto dell'energia (esempio: amido, glicogeno) e quella strutturale (della cellulosa nelle piante e della cartilagine negli animali). Inoltre giocano un ruolo fondamentale nel sistema immunitario, nella fertilità e nello sviluppo biologico.
Classificazione e struttura chimica
[modifica | modifica wikitesto]
Dal punto di vista chimico, i glucidi sono aldeidi o chetoni ai quali sono stati aggiunti vari gruppi ossidrilici, solitamente uno per ogni atomo di carbonio che non fa parte del gruppo funzionale aldeidico o chetonico. I glucidi con maggiore peso molecolare possono dunque essere considerati poliidrossialdeidi o poliidrossichetoni. La maggior parte dei glucidi può essere descritta dalla formula Cn(H2O)n, dove n è un numero maggiore o uguale a tre. Alcune eccezioni sono gli acidi uronici e i deossizuccheri come il fucosio. Esistono diverse classificazioni dei saccaridi. A seconda del numero di unità ripetitive che li compongono, possono essere suddivisi in:
- monosaccaridi: formati da una sola unità ripetitiva; tra questi si annoverano il glucosio, il galattosio, il fruttosio e il deossiribosio;
- oligosaccaridi: formati da poche unità ripetitive (in genere da 2 a 9);
- disaccaridi: formati da due unità ripetitive;
- trisaccaridi: formati da tre unità ripetitive;
- polisaccaridi: formati da molte unità ripetitive; tra questi si annovera l'amido (in genere più di 10[2]).
Le unità degli oligosaccaridi e dei polisaccaridi sono legate da legami glicosidici. I glucidi si distinguono inoltre in:
- carboidrati semplici: monosaccaridi e oligosaccaridi;
- carboidrati complessi: polisaccaridi.
I monosaccaridi e i disaccaridi vengono inoltre chiamati zuccheri.
Per estensione, vengono chiamati anche "carboidrati" molte biomolecole la cui struttura è costituita da un carboidrato a cui sono legati altri gruppi funzionali; alcuni esempi in tal senso sono gli amminozuccheri (che corrisponde ad un carboidrato al quale è legato un gruppo aminico) e le glicoproteine (che sono costituite da un carboidrato legato ad una proteina).
Classificazione dei monosaccaridi
[modifica | modifica wikitesto]
I monosaccaridi sono classificati in base a tre differenti caratteristiche:
- la posizione del loro gruppo ossidrile;
- il numero di atomi di carbonio che contengono;
- la loro chiralità.
Se il gruppo carbonilico è aldeidico, il monosaccaride è un aldoso; se il gruppo carbonilico è chetonico, il monosaccaride è un chetoso. I monosaccaridi con tre atomi di carbonio sono chiamati triosi, con quattro sono chiamati tetrosi, con cinque pentosi, con sei esosi e con sette eptosi. Questi due sistemi di classificazione sono spesso combinati. Per esempio, il glucosio è un aldoesoso, il ribosio è un aldopentoso e il fruttosio è un chetoesoso. Ogni atomo di carbonio che porta un gruppo ossidrile (-OH), ad eccezione del primo e dell'ultimo carbonio, è asimmetrico, con stereocentri con due possibili configurazioni (R o S). A causa di questa simmetria, esiste un certo numero di isomeri per ogni formula di monosaccaride. Il D-glucosio, per esempio, ha formula (C·H2O)6 e quattro dei suoi sei atomi di carbonio sono stereogeni, rendendo il D-glucosio uno dei 16 possibili stereoisomeri. Nel caso della gliceraldeide, un aldotrioso, c'è una coppia di possibili stereoisomeri, che sono enantiomeri ed epimeri. L'1-3-diidrossiacetone, il chetoso che corrisponde alla gliceraldeide aldosa, è una molecola simmetrica senza stereocentri. La classificazione in D o L è fatta in base all'orientamento del carbonio asimmetrico più lontano dal gruppo aldeidico o chetonico: in una proiezione di Fischer standard se il gruppo ossidrile è a destra della molecola, lo zucchero ha configurazione D; se è a sinistra lo zucchero ha configurazione L. Gli zuccheri di serie D sono quelli con rilevanza biologica e normalmente ci si riferisce ad essi, pertanto la D spesso viene omessa.
Classificazione dei polisaccaridi
[modifica | modifica wikitesto]I polisaccaridi si suddividono in:
- polisaccaridi simili allo zucchero;
- polisaccaridi non simili allo zucchero.
e in:
- omopolisaccaridi: costituiti da tante unità ripetitive identiche;
- eteropolisaccaridi: costituiti da unità ripetitive diverse.
La cellulosa e la chitina sono esempi di polisaccaridi. Altri polisaccaridi includono il callosio, la laminarina, lo xilano, il mannano, il fucoidano, e il galattomannano.
Ruolo biologico
[modifica | modifica wikitesto]
I carboidrati sono la più comune fonte di energia negli organismi viventi, e la loro digestione richiede meno acqua di quella delle proteine o dei grassi. Le proteine e i grassi sono componenti strutturali necessari per i tessuti biologici e per le cellule, e sono anche una fonte di energia per la maggior parte degli organismi. In particolare i monosaccaridi sono la più grande risorsa per il metabolismo. Quando non c'è immediato bisogno di monosaccaridi spesso sono convertiti in forme più vantaggiose per lo spazio, come i polisaccaridi. In molti animali, compresi gli umani, questa forma di deposito è il glicogeno, sito nelle cellule del fegato e dei muscoli. Le piante invece utilizzano l'amido come riserva. Altri polisaccaridi come la chitina, che concorre alla formazione dell'esoscheletro degli artropodi, svolgono invece una funzione strutturale. I polisaccaridi rappresentano un'importante classe di polimeri biologici. La loro funzione negli organismi viventi è di solito strutturale o di deposito. L'amido (un polimero del glucosio) è utilizzato come polisaccaride di deposito nelle piante, e si trova sia nella forma di amilosio sia in quella ramificata dell'amilopectina. Negli animali, il polimero di glucosio strutturalmente simile è il più densamente ramificato glicogeno, qualche volta chiamato "amido animale". Le proprietà del glicogeno gli permettono di essere metabolizzato più rapidamente, il che si adatta alle vite attive degli animali che si muovono. Le forme di glicogeno più diffuse sono il glicogeno epatico e glicogeno muscolare. Il glicogeno epatico si trova nel fegato, è la riserva di zucchero e di energia negli animali e dura 24 ore. Il glicogeno muscolare è la riserva di zucchero utilizzata direttamente dalle cellule muscolari senza passare per la circolazione sanguigna. Il glicogeno epatico, invece, prima di raggiungere le cellule e, in particolare il tessuto muscolare, deve essere immesso nella circolazione sanguigna. Il glucosio è rilevante nella produzione di mucina, biofilm protettivo di fegato e intestino. Il fegato deve trovarsi in una condizione di ottima salute per operare la sintesi del glucosio mancante a partire dalle proteine, come è richiesto nelle diete low-carb. La cellulosa è situata nelle pareti cellulari e in altri organismi, e si ritiene che sia la più abbondante molecola organica sulla Terra. La struttura della chitina è simile, ha delle catene laterali che contengono azoto, aumentandone la forza. Si trova negli esoscheletri degli artropodi e nelle pareti cellulari di alcuni funghi.
Ruolo nell'alimentazione
[modifica | modifica wikitesto]Una dieta completamente priva di carboidrati dà il via alla chetosi che è la condizione nella quale il corpo umano ricava energia dalla massa grassa accumulata scomponendola in corpi chetonici, o chetoni, poiché il cervello e gli altri organi hanno bisogno di energia, e questa può essere ricavata dal glucosio o dai chetoni. I carboidrati forniscono 3,75 kcal per grammo, le proteine 4 kcal per grammo, mentre i grassi forniscono 9 kcal per grammo. Nel caso delle proteine, però, quest'informazione è fuorviante in quanto solo alcuni degli amminoacidi possono essere utilizzati per ricavare energia. Allo stesso modo, negli esseri umani, solo alcuni carboidrati possono fornire energia, tra questi ci sono molti monosaccaridi e alcuni disaccaridi. Anche altri tipi di carboidrati possono essere digeriti, ma solo grazie all'aiuto dei batteri intestinali. I carboidrati complessi non assimilabili dall'uomo, come ad esempio la cellulosa, l'emicellulosa e la pectina, sono un'importante componente della fibra alimentare.[3] Cibi ricchi di carboidrati sono il pane, la pasta, i legumi, le patate, la pizza, la polenta,[4] la crusca, il riso e i cereali. La maggior parte di questi cibi sono ricchi di amido.[3] La FAO (Food and Agriculture Organization) e l'OMS (Organizzazione Mondiale della Sanità, ovvero WHO world health organization) non raccomandano una quota di carboidrati in genere, ma avvertono di non superare il consumo giornaliero del 10% di zuccheri semplici sul totale del cibo consumato, e consigliano per una buona salute di restare sotto il 5%[5]. L'indice glicemico e il carico glicemico sono dei concetti sviluppati per analizzare il comportamento del cibo durante la digestione. Questi classificano cibi ricchi di carboidrati in base alla velocità del loro effetto sul livello di glucosio nel sangue. L'indice insulinico è una classificazione simile, più recente, che classifica il cibo in base al suo effetto sui livelli di insulina nel sangue, causato dai vari macronutrienti, soprattutto dai carboidrati e da alcuni amminoacidi presenti nel cibo. L'indice glicemico è una misura di quanto velocemente i carboidrati del cibo vengono assorbiti, mentre il carico glicemico è la misura che determina l'impatto di una data quantità di glucidi presenti in un pasto.
Metabolismo
[modifica | modifica wikitesto]Le principali vie metaboliche dei monosaccaridi sono:
- La glicolisi: processo attraverso il quale una molecola di glucosio viene trasformata in due molecole di piruvato con un rilascio di energia sotto forma di 2 molecole di ATP e con la riduzione di due molecole di NAD+ a NADH + H+.
- Il ciclo di Krebs: processo continuo atto a disorganicare i due carboni presenti nell'Acetil-CoA (risultato dell'azione della piruvato deidrogenasi sul piruvato) in due molecole di anidride carbonica con un rilascio di energia sotto forma di 3 NADH + 3 H+, 1 FADH2 e 1 GTP (facilmente convertibile in ATP tramite l'azione dell'enzima nucleoside difosfato chinasi).
- Via del fosfogluconato: processo parallelo alla glicolisi atto a rifornire l'organismo di ribosio-5-fosfato e NADPH.
Gli oligosaccaridi e i polisaccaridi sono prima scissi in monosaccaridi da enzimi detti "glicosidasi" per poi essere catabolizzati singolarmente. In alcuni casi, come per la cellulosa, il legame glicosidico è particolarmente difficile da scindere e pertanto sono necessari enzimi specifici (in questo caso la cellulasi) senza i quali è impossibile catabolizzare tali zuccheri.
Riduzione e ossidazione dei carboidrati
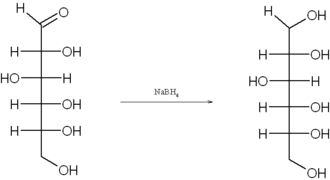
[modifica | modifica wikitesto]Pur esistendo prevalentemente in forma emiacetalica ciclica, i glucidi sono in equilibrio con la loro forma a catena aperta. Ciò rende il gruppo aldeidico soggetto a reazioni di riduzione, solitamente utilizzando l'idrogenazione catalica o il tetraidroborato di sodio. Una applicazione di questa reazione consiste nella sintesi del dolcificante sorbitolo, ottenuto dalla riduzione del D-glucosio:
La funzione aldeidica è anche soggetta a ossidazione, per esempio con bromo, formando i composti noti come acidi aldonici. Utilizzando condizioni ossidative più drastiche, per esempio impiegando acido nitrico, è possibile ossidare anche il gruppo -CH2OH terminale, producendo gli acidi aldarici. Acidi aldonici e aldarici tendono a esistere principalmente sotto forma di lattoni. Infine è possibile che si verifichi solamente l'ossidazione del gruppo -CH2OH terminale con il gruppo -CHO che resta inalterato, producendo gli acidi uronici. La formazione di questo genere di composti avviene prevalentemente per via biochimica per azione di enzimi, dato che con i reattivi chimici risulta favorita l'ossidazione del gruppo aldeidico. Un esempio di acido uronico è rappresentato dall'acido glucuronico, ottenuto per ossidazione del D-glucosio e che ricopre un ruolo importante nell'escrezione delle sostanze tossiche per via urinaria. In generale, gli zuccheri suscettibili di ossidazione vengono definiti zuccheri riducenti. Sono riducenti tutti quegli zuccheri il cui carbonio anomerico non è impegnato in un legame stabile, come nel caso dei glicosidi e disaccaridi come il saccarosio. Oltre agli aldosi, anche i chetosi sono zuccheri riducenti, in quanto presentano anche loro una funzione aldeidica in seguito a un equilibrio con un intermedio enediolico (diolo con un doppio legame, R-C(OH)(CHOH)). I reattivi di Benedict e quello di Fehling sono di comune utilizzo nella pratica di laboratorio per la determinazione delle proprietà riducenti degli zuccheri.
Scissione ossidativa
[modifica | modifica wikitesto]Menzione a parte merita l'ossidazione con acido periodico, in quanto quest'ultima provoca anche una scissione della molecola glucidica. La reazione, utilizzata per la determinazione della struttura dei carboidrati, implica la rottura del legame di un 1,2-diolo con formazione di due chetoni:
o di un composto α-idrossi carbonilico con formazione di un acido carbossilico e di un chetone:
Quando sono presenti tre atomi di carbonio contigui legati a gruppi la reazione consuma due moli di acido periodico e il carbonio centrale viene ossidato ad acido formico ():
Il legame evidenziato col trattino è quello che subisce la scissione.
Formazione dell'emiacetale
[modifica | modifica wikitesto]Il gruppo aldeidico o chetonico di una catena lineare di un monosaccaride reagirà reversibilmente con un gruppo ossidrile su un altro atomo di carbonio per formare un emiacetale o un emichetale, formando un anello eterociclico con un ponte ossigeno tra i due atomi di carbonio. Gli anelli con cinque o sei atomi sono chiamati furanosi e piranosi ed esistono in equilibrio con la forma a catena aperta. Durante la conversione dalla forma a catena aperta alla forma ciclica, l'atomo di carbonio contenente l'ossigeno carbonilico, chiamato carbonio anomerico, diventa un centro chirale con due possibili configurazioni: l'atomo di ossigeno può prendere posizione sopra o sotto il piano dell'anello. I due possibili stereoisomeri risultanti sono detti anomeri. Nell'anomero α, l'-OH che sostituisce il carbonio anomerico sta dal lato opposto (trans) dell'anello (secondo CH2OH). La forma alternativa dà l'anomero β. Dato che l'anello e la forma a catena aperta si interconvertono velocemente, entrambi gli anomeri esistono all'equilibrio.
L'anomeria risulta essere molto importante quando gli zuccheri reagiscono formando molecole grandi come polisaccaridi o oligosaccaridi tramite legami chiamati glucosidici. Un monosaccaride può essere legato chimicamente ad un altro monosaccaride dal legame che si forma tra un carbonio anomerico dell'uno e il gruppo ossidrilico dell'altro. La distinzione tra il legame α-glucosidico e β-glucosidico è molto importante perché nel nostro apparato digerente sono presenti enzimi chiamati α-amilasi in grado si scindere appunto solo il legame α e non quello β. Facendo un esempio l'amido presenta legami α-glucosidici che possono essere sciissi dagli enzimi salivari e pancreatici; la cellulosa, che come l'amido è un polimero di glucosio, presenta legami β-glucosidici non attaccabili dagli enzimi umani.
- α-D-Glucopiranosio
- β-D-Glucopiranosio
La mutarotazione è un fenomeno, legato proprio all'instaurarsi di un equilibrio tra anomeri, che consiste nella variazione del potere rotatorio dei carboidrati osservato in una loro soluzione.
Glicosidi
[modifica | modifica wikitesto]Quando un emiacetale reagisce con una funzione alcolica di un altro composto chimico si ottiene un glicoside. La parte non zuccherina del composto ottenuto viene chiamata aglicone. I glicosidi, impegnando il carbonio anomerico nella formazione di un legame etereo stabile, a differenza degli zuccheri originari non presentano mutarotazione. Sono soggetti a idrolisi per azione di acidi in soluzione acquosa.
I glicosidi rappresentano una classe di sostanze molto diffuse in natura e diversi di loro possiedono proprietà farmacologiche.
Sintesi di Kiliani-Fischer
[modifica | modifica wikitesto]La sintesi di Kiliani-Fischer permette l'omologazione dei carboidrati, ovvero consente l'allungamento della catena. Viene realizzata facendo reagire lo zucchero di partenza con un cianuro, tipicamente NaCN, che produce una addizione nucleofila al gruppo carbonilico aggiungendo un nuovo gruppo nitrilico (-C≡N) e generando due epimeri. Il nitrile viene successivamente trasformato in acido carbossilico in seguito a idrolisi, e questo forma un lattone. A questo punto si separa il diastereomero che interessa e lo si sottopone a riduzione con amalgama di sodio. In tal modo si ottiene un nuovo zucchero che differisce dallo zucchero di partenza per la presenza di un atomo di carbonio in più, senza variazione della stereochimica degli altri atomi di carbonio chirali.
Utilizzi
[modifica | modifica wikitesto]Molti zuccheri, tra cui il saccarosio (che viene chiamato "zucchero" per antonomasia[3]) e il fruttosio, vengono utilizzati a scopo alimentare. In particolare il saccarosio viene estratto dalla canna da zucchero e dalla barbabietola da zucchero.
La cellulosa ha un ruolo significativo nell'industria tessile e della carta, ed è usata come materia prima per la produzione di rayon, acetato di cellulosa, celluloide, e nitrocellulosa.
La chitina ha molti usi, tra cui il filo di sutura chirurgico.
Note
[modifica | modifica wikitesto]- ^ The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - saccharides (S05441), su goldbook.iupac.org. URL consultato il 27 gennaio 2024.
- ^ (EN) IUPAC Gold Book, "polysaccharides"
- ^ a b c Briggs.
- ^ Alessandra Margreth, Alimentazione: la regola delle cinque P, su saperesalute.it, 26 agosto 2021. URL consultato il 5 settembre 2024.«Il glucosio di cui sono fonte i carboidrati complessi del pane, della pasta, della pizza, delle patate e della polenta ha compiti importanti.»
- ^ https://www.who.int/news-room/fact-sheets/detail/healthy-diet
Bibliografia
[modifica | modifica wikitesto]- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 901-938, ISBN 88-08-09414-6.
- (EN) David Briggs, Mark Wahlqvist, Visionary Voyager, Food Facts - Carbohydrate, Penguin Books, 1998. URL consultato il 17 novembre 2016 (archiviato dall'url originale il 7 ottobre 2016).
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni sui glucidi
Wikiquote contiene citazioni sui glucidi Wikimedia Commons contiene immagini o altri file sui glucidi
Wikimedia Commons contiene immagini o altri file sui glucidi
Collegamenti esterni
[modifica | modifica wikitesto]- carboidrati, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) Eugene A. Davidson, carbohydrate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Esperienze in laboratorio - I carboidrati, su itchiavari.org.
- Lidia Baratta, Diete senza pane e pasta Pochi carboidrati e la memoria svanisce, su salute24.ilsole24ore.com, Il Sole 24 Ore, 16 dicembre 2008. URL consultato il 19 settembre 2020 (archiviato dall'url originale l'8 luglio 2012).
| Controllo di autorità | Thesaurus BNCF 1313 · LCCN (EN) sh85020080 · GND (DE) 4164517-0 · BNE (ES) XX530029 (data) · BNF (FR) cb11961088k (data) · J9U (EN, HE) 987007283489605171 · NDL (EN, JA) 00572696 |
|---|


 French
French Deutsch
Deutsch