Sakwinawir – Wikipedia, wolna encyklopedia
| |||||||||||||||||||||
 | |||||||||||||||||||||
| |||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||
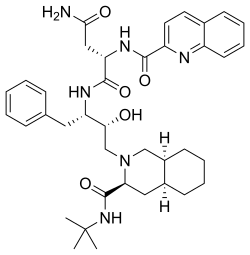
| Wzór sumaryczny | C38H50N6O5 | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 670,86 g/mol | ||||||||||||||||||||
| Wygląd | biały lub prawie biały drobnokrystaliczny proszek[1] | ||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||
| PubChem | |||||||||||||||||||||
| DrugBank | |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||
| ATC | |||||||||||||||||||||
| Stosowanie w ciąży | |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
Sakwinawir (łac. saquinavirum) – wielofunkcyjny organiczny związek chemiczny, pierwszy poznany inhibitor proteaz, lek stosowany w leczeniu zakażeń ludzkim wirusem niedoboru odporności.
Mechanizm działania
[edytuj | edytuj kod]Sakwinawir, poprzez zablokowanie proteazy HIV, powoduje uwalnianie niedojrzałych postaci ludzkiego wirusa niedoboru odporności, które są niezakaźne[4]. Jest pierwszym lekiem z grupy inhibitorów proteaz, zaprojektowanym po ustaleniu struktury oraz farmakoforu proteazy HIV-1[4].
Zastosowanie
[edytuj | edytuj kod]- leczenie zakażeń ludzkim wirusem niedoboru odporności (HIV-1) jednocześnie z rytonawirem oraz innymi przeciwretrowirusowymi produktami leczniczymi u dorosłych pacjentów[5].
Sakwinawir znajdował się na wzorcowej liście podstawowych leków Światowej Organizacji Zdrowia (WHO Model Lists of Essential Medicines) w latach 2002-2015[6][7][8].
Sakwinawir jest dopuszczony do obrotu w Polsce (2018)[9].
Działania niepożądane
[edytuj | edytuj kod]Sakwinawir może powodować następujące działania niepożądane u ponad 10% pacjentów: biegunka, nudności, małopłytkowość, zwiększenie stężenia cholesterolu, trójglicerydów, lipoprotein niskiej gęstości (LDL), aktywności aminotransferazy alaninowej, aminotransferazy asparaginianowej w surowicy, natomiast u ponad 1% pacjentów: nadwrażliwość, cukrzyca, jadłowstręt, zwiększenie apetytu, zmniejszenie libido, zaburzenia snu, parestezje, neuropatia, zawroty głowy, zaburzenia smaku, ból głowy, duszność, wymioty, ból brzucha, ból w nadbrzuszu, zaparcia, kserostomia, dyspepsja, odbijania ze zwracaniem treści żołądkowej, wzdęcia z oddawaniem gazów jelitowych, wysychanie warg, luźne stolce, łysienie, sucha skóra, wyprysk, lipoatrofia, świąd, wysypka, kurcz mięśni, osłabienie, zmęczenie, nadmierny przyrost tkanki tłuszczowej, złe samopoczucie, zwiększenie stężenia kreatyniny, bilirubiny oraz aktywności amylazy w surowicy[5].
Przypisy
[edytuj | edytuj kod]- ↑ a b c d Saquinavir, [w:] PubChem [online], United States National Library of Medicine, CID: 441243 (ang.).
- ↑ Saquinavir, Mesylate SC-208383. Santa Cruz Biotechnology. [dostęp 2018-06-24]. (ang.).
- ↑ Drugs and Supplements Saquinavir (Oral Route). Mayo Foundation for Medical Education and Research, 2017-03-01. [dostęp 2018-06-24]. (ang.).
- ↑ a b c d e Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii. T. 2. Warszawa: Medical Tribune, 2010, s. 751-752. ISBN 978-83-60135-95-2.
- ↑ a b c d e Roche: INVIRASE 200 mg kapsułki twarde. Charakterystyka Produktu Leczniczego. Europejska Agencja Leków, 2006. [dostęp 2018-06-24].
- ↑ Comparative Table of Medicines on the WHO Essential Medicines List from 1977- 2011. Światowa Organizacja Zdrowia. [dostęp 2018-06-24]. (ang.).
- ↑ WHO Model List of Essential Medicines 19th List. Światowa Organizacja Zdrowia, 2015. s. 12. [dostęp 2018-06-24]. (ang.).
- ↑ WHO Model List of Essential Medicines 20th List. Światowa Organizacja Zdrowia, 2017. s. 20. [dostęp 2018-06-24]. (ang.).
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 16 kwietnia 2018 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej. Dziennik Urzędowy Ministra Zdrowia, 2018-04-16. [dostęp 2018-06-24].


 French
French Deutsch
Deutsch