Linus Pauling – Wikipédia, a enciclopédia livre
Linus Carl Pauling (Portland, 28 de fevereiro de 1901 — Big Sur, 19 de agosto de 1994) foi um químico quântico e bioquímico dos Estados Unidos. Também é reconhecido como cristalógrafo, biólogo molecular e pesquisador médico.
Pauling é amplamente reconhecido como um dos principais químicos do século XX. Foi pioneiro na aplicação da Mecânica Quântica em química e, em 1954, foi galardoado com o Nobel de Química pelo seu trabalho relativo à natureza das ligações químicas. Também efetuou importantes contribuições relativas à determinação da estrutura de proteínas e cristais, sendo considerado um dos fundadores da Biologia Molecular. Durante as suas investigações esteve perto de descobrir a estrutura em hélice dupla do ADN, descoberta essa efectuada mais tarde por James Watson e Francis Crick, em 1953.
É ainda referenciado como sendo um académico versátil, devido à sua intervenção e perícia em campos diversos como a química inorgânica, química orgânica, metalurgia, imunologia, anestesiologia, psicologia e radioatividade.
Pauling recebeu o Nobel da Paz de 1962, pela sua campanha contra os testes nucleares e é a única personalidade a ter recebido dois Prémios Nobel não compartilhados. As outras personalidades que receberam dois Prémios Nobel foram Marie Curie (Física e Química), John Bardeen (ambos em Física), Frederick Sanger (ambos em Química) e Barry Sharpless (ambos em Química). Mais tarde na sua carreira científica, advogou o uso em maiores proporções, em dietas, de vitamina C e outros nutrientes. Generalizou as suas ideias nesta área com vista a definir Medicina Ortomolecular, que ainda é vista como método não ortodoxo pela Medicina convencional. Pauling popularizou as suas ideias, análises, pesquisa e visões em vários livros de sucesso, mas controversos, sobre a temática da vitamina C e Medicina Ortomolecular.
Juventude
[editar | editar código-fonte]
Nascido no noroeste dos Estados Unidos, filho de Hermann Heinrich William Pauling (1876-1910), de ascendência alemã, e de Lucy Isabelle Darling (1881-1926).[1] Os Pauling, de acordo com John Simmons, pertenciam a uma família peculiar; a tia de Linus chamava-se Stella "Dedos" Darling e era uma conhecida arrombadora de cofres.[2] Seu pai era um farmacêutico que, sem ter êxito comercial, fez que a sua família percorresse diferentes lugares do estado do Oregon.[1] Quando o seu pai morreu, em 1910, Lucy Isabelle teve que criar sozinha Linus e as suas duas irmãs, Pauline (1901-2003) e Frances Lucille (1904-1973). A família voltaria mais tarde a reinstalar-se em Portland.[1]
Durante a infância, Linus foi um leitor voraz, tanto que o seu pai chegou a escrever para um periódico local, pedindo sugestões de livros para mantê-lo ocupado.[1] Um dos seus amigos, Lloyd Jeffress, tinha um pequeno laboratório químico na sua habitação; e as experiências levadas a cabo neste laboratório despertaram o interesse de Pauling em se tornar um engenheiro químico.[1]
Durante os seus estudos no ensino médio, Pauling continuava com as experiências de química, buscando a maioria dos materiais e equipamentos utilizados em uma fábrica abandonada que existia perto do local onde o seu avô tinha trabalhado como guarda noturno.[1]
As más classificações que Pauling obteve em história dos Estados Unidos impediram-no de obter, nessa altura, o seu diploma de ensino médio. A escola concedeu-lhe o diploma quarenta e cinco anos mais tarde, depois de ter ganho os seus dois Prémios Nobel.[1]
Estudos
[editar | editar código-fonte]
Em 1917, Pauling ingressou na Universidade Agrícola do Oregon ("OAC", denominada atualmente de Universidade Estadual do Oregon), em Corvallis. Paralelamente aos seus estudos, Linus Pauling teve que trabalhar a tempo inteiro, devido às suas necessidades financeiras. Entre os empregos que teve, encontram-se o de distribuidor de leite, projeccionista num cinema e como trabalhador num estaleiro naval. No começo do seu segundo ano de estudos, Pauling propôs-se a encontrar emprego em Portland para poder ajudar financeiramente a sua mãe. Na mesma altura, na Universidade, propuseram-lhe que aceitasse uma cátedra de química analítica quantitativa (um curso que ele mesmo acabava de concluir como estudante), que lhe permitiria, ao mesmo tempo, continuar os seus estudos.
Durante os seus dois últimos anos na OAC, Pauling estudou o trabalho de Lewis e Langmuir sobre a configuração electrónica dos átomos, assim como a forma como estes se ligavam para formar moléculas. Neste momento, decidiu seguir uma carreira de investigação, concentrando-se na compreensão da relação da estrutura atómica da matéria com as suas propriedades físicas e químicas, o que o levaria a converter-se num dos pioneiros da química quântica. Na OAC, teve a oportunidade de realizar as suas primeiras investigações respeitantes ao efeito que um campo magnético exerce sobre a orientação de um cristal de ferro.
Pauling gradou-se como Bachelor of Science, em 1922, na área de engenharia química. Imediatamente, procurou continuar os estudos com uma pós-graduação no Instituto de Tecnologia da Califórnia (Caltech) em Pasadena. Em busca do doutoramento, Pauling investigou a utilização da difração de raios-X, na determinação das estrutura dos cristais. Durante os seus três anos em Caltech, Pauling publicou sete artigos sobre a estrutura cristalina dos minerais. O primeiro deles foi publicado na revista Journal of the American Chemical Society, e tratava a estrutura da molibdenita, MoS2.[3] Linus Pauling recebeu o doutoramento summa cum laude em 1925.
A 17 de Junho de 1923, Pauling casou-se com Ava Helen Miller, com quem teve três filhos e uma filha. O casal tinha-se conhecido na OAC, quando Pauling cursava o último ano de estudos. Miller foi aluna de Pauling no curso "Química para estudantes de Economia Doméstica".[4]
Carreira científica
[editar | editar código-fonte]Início
[editar | editar código-fonte]Tendo em vista a conclusão do seu doutoramento, Pauling recebeu uma bolsa da Fundação Guggenheim, que lhe permitiu viajar para a Europa, onde estudou sob a orientação de Arnold Sommerfeld em Munique, Niels Bohr em Copenhaga e Erwin Schrödinger em Zurique. Durante a sua estadia na OAC, Pauling tinha-se familiarizado com o trabalho dos três cientistas, pioneiros da química quântica. Teve ainda a oportunidade de presenciar um dos primeiros estudos, baseados em química quântica, sobre as ligações da molécula de hidrogénio. A investigação foi realizada por Walter Heitler e Fritz London. Pauling consagrou os seus anos na Europa a esta área, e decidiu torná-la a matéria principal das suas investigações futuras. Quando Pauling voltou aos Estados Unidos em 1927, obteve a posição de Professor assistente de química teórica em Caltech.
Os primeiros cinco anos da carreira de Pauling, decorridos em Caltech, foram muito produtivos, tendo aplicado a mecânica quântica ao estudo de átomos e moléculas, no seguimento de seus estudos sobre cristais, utilizando a difração de raios X. Neste período, Pauling publicou cerca de cinquenta artigos, e criou as cinco regras de Pauling, desenvolvidas para determinar a estrutura molecular dos cristais complexos. Em 1929, foi nomeado Professor associado, e no ano seguinte recebeu o título de Professor.
Em 1930, Pauling teve uma estadia de verão na Europa, durante a qual trabalhou no instituto de Arnold Sommerfeld. Nesse período, Pauling viu a possibilidade de utilizar os electrões para os estudos de difração, tal como tinha usado, para o mesmo efeito, os raios X. No seu regresso, construiu um aparelho de difração electrónica, auxiliado pelo estudante L. O. Brockway. O aparelho foi utilizado para estudar a estrutura molecular de um grande número de substâncias químicas. Em 1931, Pauling recebeu o Prémio Langmuir, outorgado pela American Chemical Society, pelo trabalho científico mais significativo, realizado por um investigador com menos de 30 anos.

Em 1932, Pauling concebeu a noção de electronegatividade. Utilizando diversas propriedades das moléculas, especialmente o seu momento dipolar e a energia necessária para romper as ligações químicas, estabeleceu a escala de Pauling, útil para a previsão da natureza das ligações químicas. A escala atribui um valor de electronegatividade à maioria dos elementos químicos. Este valor resulta da medida da força com que os átomos de uma molécula se atraem entre si. Nesse mesmo ano, Pauling publicou o que é considerado o seu artigo mais importante, em que desenvolve o novo conceito de hibridização das orbitais atómicas, e realiza uma análise do carácter tetravalente do carbono.
Pauling desenvolveu uma forte amizade com Robert Oppenheimer, da Universidade da Califórnia (Berkeley), que deslocava-se regularmente a Caltech como investigador e professor. Oppenheimer e Pauling planejaram trabalhar em conjunto na investigação das ligações químicas. Oppenheimer efectuaria os cálculos matemáticos e Pauling interpretaria os resultados. No entanto, os planos não se desenvolveram por completo, pois Pauling começou a suspeitar que o seu amigo se estava a aproximar demasiado da sua esposa, Ava Helen. Numa ocasião em que Pauling estava ausente a trabalhar, Oppenheimer convidou Ava Helen a encontrar-se com ele no México. Ela recusou o convite de imediato, tendo avisado o seu marido. Este incidente, e a indolência com que Ava Helen o tomou, levaram Pauling a pôr fim à relação com o cientista de Berkeley, criando uma fria tensão que durou para o resto das suas vidas. Mais tarde, Oppenheimer propôs a Pauling a chefia na área de química do Projecto Manhattan. Pauling recusou a proposta, argumentando que era pacifista.
A natureza da ligação química
[editar | editar código-fonte]No início da década de 1930, Pauling começou a publicar as suas investigações sobre a natureza da ligação química, que levou, depois, à edição do seu famoso livro de texto The Nature of the Chemical Bond, publicado em 1939. Este livro é considerado um dos mais importantes trabalhos de química jamais publicados. Pode-se ter uma ideia da sua influência bastando recordar que nos primeiros trinta anos após a sua primeira edição, o livro foi citado mais de 16 mil vezes por outros autores, o que faz dele a investigação mais citada como referência no meio científico. As investigações nesta área valeram a Pauling o Nobel de Química de 1954, "pelas suas investigações sobre a natureza da ligação química e suas aplicações na determinação da estrutura das substâncias complexas".

Como parte das suas investigações sobre a natureza da ligação química, Pauling criou o conceito de hibridização das orbitais atómicas. A mecânica quântica utiliza o número quântico l para determinar o número máximo de electrões em cada orbital (denominando as orbitais com as letras s, p, d, f, g e h); Pauling observou que para descrever a ligação química nas moléculas, é preferível construir funções que são uma mistura destas orbitais. Por exemplo, as orbitais 2s e 2p de um átomo de carbono, podem-se combinar para formar quatro orbitais equivalentes, chamadas orbitais híbridas sp³. Estas orbitais híbridas podem descrever melhor a existência de compostos como o metano, de geometria tetraédrica. De forma similar, a orbital 2s pode combinar-se com duas orbitais 2p, formando três orbitais equivalentes, chamados orbitais híbridos sp², sendo que a terceira orbital 2p não se hibridiza. Esta estrutura permite descrever os compostos insaturados, como o etileno.
Pauling estava também interessado em compreender a relação entre as ligações iónicas, em que os electrões são transferidos de um átomo para outro, e as ligações covalentes, em que ambos os átomos fornecem electrões. Pauling demonstrou que estes dois tipos de ligação são, na realidade, casos extremos, e que a maioria das ligações químicas são na realidade uma combinação de ligação iónica com covalente. É nesta temática onde a noção de electronegatividade é especialmente útil, pois a diferença entre as electronegatividades dos átomos participantes numa ligação é a medida mais adequada para prever o grau de ionicidade de uma ligação.

Ainda na área das ligações químicas, o terceiro tema estudado por Pauling incidia na compreensão e descrição da estrutura dos compostos aromáticos; especialmente o benzeno (C6H6), o composto mais simples dentro dos aromáticos.
A estrutura do benzeno sempre havia sido motivo de controvérsia entre os cientistas, pois não era clara a forma como seis átomos de carbono e seis de hidrogénio poderiam conectar-se, satisfazendo todo o seu potencial de ligação.[5] Até essa altura, a melhor descrição sobre a dita estrutura, era a formulada pelo químico alemão Friedrich Kekulé. Kekulé descrevia o benzeno como a transição rápida entre duas estruturas em que havia alternância de posição das ligações simples e duplas. Pauling propôs uma estrutura intermédia, baseada na mecânica quântica, que considera uma sobreposição das duas estruturas de Kekulé. Posteriormente, este fenómeno recebeu o nome de ressonância (ou mesomeria).
De certo modo, a ressonância é análoga ao fenómeno de hibridização das orbitais atómicas, já que consiste na combinação de várias estruturas electrónicas: nela, as orbitais de diferentes átomos de carbono combinam-se para formar as orbitais moleculares.
Estrutura do núcleo atômico
[editar | editar código-fonte]A 16 de Setembro de 1952, Linus Pauling começou um novo caderno de apontamentos com as palavras "Decidi atacar o problema da estrutura do núcleo".[6] Treze anos depois, Pauling publicou o seu modelo de núcleo atómico nas revistas Science e Proc. Natl. Acad. Sci.[7] Durante as seguintes três décadas, Pauling continuou a publicar artigos baseados no dito modelo.
No entanto, poucos livros de texto modernos referem este modelo. O modelo dá uma perspectiva única sobre a forma como cadeias de núcleos podem formar estruturas, de acordo com a mecânica quântica. Em 2006, Norman D. Cook, na sua revisão sobre vários modelos de estrutura atómica, disse sobre o modelo de Pauling que "leva a uma construção sensata dos núcleos e tem uma lógica inerentemente difícil de negar....no entanto....os teóricos nucleares não aprofundaram a ideia, e o modelo de Pauling não entrou no comum da investigação atómica teórica", não concluindo que o modelo de Pauling fora substituído por um modelo superior, mas simplesmente ignorado.
As cadeias de Pauling, incluem os isótopos deutério, hélio e trítio. Os núcleos eram descritos como cadeias de partículas alfa, o que é frequente para núcleos leves. Pauling tentou descrever a estrutura nuclear a partir dos sólidos platónicos, em vez de partir de um modelo de partículas baseado no princípio de exclusão de Pauli, mais tradicional. Foi por vezes dito que estas investigações teriam recebido maior atenção da comunidade científica se tivessem sido levadas a cabo por um cientista menos famoso; mais certo era que Pauling estava a tentar, de forma inovadora, entender o trabalho de Maria Goeppert-Mayer, efectuado no fim da década de 1940, respeitante à estrutura do núcleo atómico.
Investigações em biologia molecular
[editar | editar código-fonte]Em meados da década de 1930, Pauling interessou-se por uma nova disciplina científica. No início da sua carreira, havia manifestado falta de interesse pelo estudo das moléculas biológicas. No entanto, enquanto esteve em Caltech, teve oportunidade de relacionar-se com biólogos de renome, como Thomas Hunt Morgan, Theodosius Dobzhansky, Calvin Bridges e Alfred Sturtevant, que o levaram a mudar de opinião. Começou, então, a estudar estas moléculas, graças a uma bolsa de estudo da Fundação Rockefeller. Os seus primeiros trabalhos no tema incidiram sobre a estrutura da hemoglobina. Pauling propôs que a estrutura da hemoglobina se altera em função do ganho ou perda de um átomo de oxigénio pela molécula. Na sequência desta observação, Linus Pauling decidiu estudar de forma mais precisa a estrutura das proteínas, utilizando a difração de raios-X, mas a estrutura proteica mostrou ser muito mais difícil de determinar usando esta técnica, em comparação com a estrutura dos cristais de minerais estudados anteriormente. Nesta década, o cristalógrafo britânico William Astbury tinha obtido bons resultados usando raios-X, mas quando Pauling tentou reinterpretar as suas observações, em 1937, com auxílio da mecânica quântica, não o conseguiu.
Foram necessários onze anos até que Pauling compreendesse a origem do problema. A sua análise matemática estava correta, mas os resultados de Astbury foram obtidos de tal maneira que as proteínas estavam inclinadas em relação às posições esperadas. Para explicar esta discrepância, Pauling propôs um modelo molecular da hemoglobina, no qual os átomos estavam posicionados em hélice, e aplicou esta ideia às proteínas em geral.
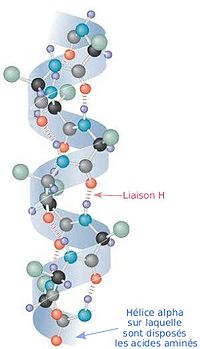
Em 1951, com base nas estruturas dos aminoácidos e dos péptidos, e considerando a natureza planar da ligação peptídica, Pauling e seus colegas propuseram que a estrutura secundária das proteínas era baseada na alfa-hélice e na folha-beta. Esta conclusão exemplifica a capacidade de Pauling para pensar de maneira não convencional, pois a assumpção central da proposta radicava no facto de uma volta de hélice poder conter um número não inteiro de aminoácidos.
No seguimento, Pauling sugeriu uma estrutura helicoidal para o ácido desoxirribonucleico (ADN), ainda que o seu modelo tivesse alguns erros, incluindo a proposição de grupos neutros de fosfato, ideia que estava em conflito com a natureza ácida, e não neutra, do ADN.[8] Sir Lawrence Bragg decepcionou-se, ao saber que Pauling tinha ganho a corrida para a descoberta da alfa-hélice. A equipa de Bragg tinha cometido um erro fundamental, ao não considerar a natureza planar da ligação peptídica. Quando nos Laboratórios Cavendish se soube que Pauling trabalhava com os modelos moleculares da estrutura do ADN, James Watson e Francis Crick foram autorizados a propor um modelo estrutural da molécula de ADN, utilizando material não publicado, dos investigadores Maurice Wilkins e Rosalind Elsie Franklin, do King's College. Em 1953, Watson e Crick propuseram a estrutura, ainda hoje considerada correta, para a dupla hélice do ADN, o que lhes valeria o Nobel de Fisiologia ou Medicina de 1962. Um dos obstáculos que Pauling enfrentou durante a sua investigação foi a impossibilidade de consultar as fotografias de alta qualidade de difração do ADN que Franklin tinha efectuado. Quando Pauling as tentou ver num congresso em Inglaterra, o seu passaporte foi retido pelo Departamento de Estado dos Estados Unidos, sob a suspeita de ter simpatias pelo comunismo.[9]
Durante este período, Pauling também estudou as reacções enzimáticas. Encontra-se entre os primeiros cientistas que demonstraram que as enzimas atuam estabilizando os estados de transição das reacções químicas, o que é fundamental para a compreensão do seu mecanismo de ação. Pauling está também entre os primeiros que propuseram que os anticorpos se ligam aos antigénios graças a uma compatibilidade das suas estruturas. Seguindo a mesma ordem de ideias, escreveu um artigo juntamente com Max Delbrück, um físico convertido em biólogo, onde sugeria que a replicação do ADN é devida à complementaridade, e não à similitude, como tinha sido sugerido por outros cientistas. O modelo de Watson e Crick viria a corroborar esta ideia. Por outra parte, Pauling contribuiu também, juntamente com outros investigadores, para o fabrico de anticorpos artificiais, e para um substituto do plasma sanguíneo.
Genética molecular
[editar | editar código-fonte]Em Novembro de 1949, juntamente com Harvey Itano, S. J. Singer e Ibert Wells, Pauling publicou na revista Science a primeira prova da relação entre uma doença humana e uma alteração numa proteína específica.[10] Utilizando a técnica de electroforese, demonstraram que a hemoglobina sofrera modificações em pacientes com anemia falciforme, e que pacientes que eram propensos a este tipo de anemia, sem tê-la desenvolvido, tinham dois tipos de hemoglobina: modificada e não modificada. Esta publicação foi a primeira demonstração de que a hereditariedade mendeliana determinava as propriedades físicas específicas das proteínas e não apenas a sua presença ou ausência, marcando assim os primeiros passos da genética molecular.
Automóvel elétrico
[editar | editar código-fonte]
Nos finais da década de 1950, Pauling começou a interessar-se pelo problema da poluição atmosférica e particularmente pelo fenômeno do smog, que tinha vindo a crescer na cidade de Los Angeles. Nesta época, a maioria dos cientistas pensavam que o smog se devia às emissões das refinarias e indústrias químicas. Graças aos trabalhos de Pauling, Arie Haagen-Smit e outros investigadores de Caltech, demonstrou-se que o principal responsável do smog eram as emissões dos automóveis. Pouco tempo depois desta descoberta, começou a trabalhar no desenvolvimento de um automóvel elétrico que fosse funcional, mas barato. Para isso, uniu os seus esforços com os engenheiros da empresa Eureka Williams, com vista ao desenvolvimento do primeiro automóvel eléctrico de velocidade controlável, o Henney Kilowatt. Depois de ter trabalhado no sistema de propulsão, Pauling demonstrou que os acumuladores clássicos não podiam proporcionar uma potência suficiente para fazer os motores eléctricos comparáveis aos motores de combustão interna. Também previu que o Henney Kilowatt seria pouco popular, devido à baixa velocidade que alcançava e à sua reduzida autonomia. Dirigiu-se, então, à empresa Eureka Williams para pedir que detivessem o projeto até que se desenvolvesse uma bateria mais potente. A empresa preferiu fazer o lançamento, que conduziu a um fracasso comercial.
Medicina e vitaminas
[editar | editar código-fonte]Depois de ultrapassar os quarenta anos de idade, em 1941, Pauling descobriu que estava afetado por uma forma grave da doença de Bright, uma enfermidade renal potencialmente mortal, considerada incurável pela medicina da época. Com a ajuda do doutor Thomas Addis, de Stanford, Pauling conseguiu controlar a doença seguindo uma dieta pobre em proteínas e sem sal, algo fora do comum para a época. Addis também receitava a todos os seus pacientes maiores consumos de vitaminas e sais minerais e Pauling não foi uma excepção.
Em finais da década de 1950, Pauling investigou a ação das enzimas sobre as funções cerebrais. Pensava que as doenças mentais poderiam ser causadas, em parte, por disfunções enzimáticas. Quando em 1965 leu "A terapia de niacina em psiquiatria", publicação de Abram Hoffer, deu-se conta de que as vitaminas podiam ter importantes efeitos bioquímicos no organismo, para além dos relacionados com a prevenção de doenças provocadas por deficiência vitamínica. Em 1968, Pauling publicou na revista Science o seu mais importante artigo nesta área: "Psiquiatria ortomolecular [....]" (PMID 5641253), em que inventou a palavra ortomolecular para descrever o conceito de controlo da concentração dos compostos presentes no corpo humano, no sentido de prevenir e tratar doenças. As ideias aí apresentadas constituíram a base da Medicina Ortomolecular, fortemente criticada pelos profissionais da medicina tradicional.[11][12]

Nos anos seguintes, as investigações de Pauling sobre a vitamina C foram fonte de controvérsias, e alguns consideraram-nas fruto de charlatanismo.[13] Em 1966, Irwin Stone desenvolveu o conceito de cura à base de altas doses de vitamina C. Depois deste desenvolvimento, Pauling começou a tomar vários gramas da vitamina (3 gramas por dia, segundo algumas fontes[14]) para prevenir os resfriados. Entusiasmado com os resultados, interessou-se pela literatura sobre o tema, e em 1970 publicou "Vitamin C and the Common Cold" ("A vitamina C e o resfriado comum"). No ano seguinte, Pauling iniciou uma extensa colaboração com o oncologista britânico Ewan Cameron,[15] trabalhando sobre o uso da vitamina C por via intravenosa ou por via oral em doentes de cancro em fase terminal.
Cameron e Pauling escreveram vários artigos e um livro de divulgação chamado "A vitamina C e o cancro", descrevendo as suas observações. Ainda que os resultados parecessem ser favoráveis, a campanha de publicidade negativa de que foi alvo, minou-lhe a credibilidade e as suas investigações durante muitos anos.
Desde as suas campanhas de luta contra os testes nucleares, na década de 1950, até às suas investigações em Biologia Ortomolecular, Pauling sempre esteve na corda bamba. Em 1985, Pauling ficou sem apoio, tanto financeiro institucional, como dos seus colegas. Não obstante, Pauling colaborou com o médico Abram Hoffer no desenvolvimento de uma dieta que incluía a vitamina C em altas doses, como um tratamento complementar contra o cancro.
A ideia que Pauling promoveu, de elevar as doses de vitamina C de forma prolongada para prevenir várias doenças, sempre foram causa de controvérsia (QuackWatch,[16] Plos,[17] WebMD[18]), não impedindo, no entanto, que estudos posteriores voltassem a abordar o tema. Alguns médicos foram chamados para uma reavaliação cuidadosa do papel da vitamina C,[19] especialmente na forma intravenosa para o tratamento do cancro,[20][21] que continua também a ser controverso[22] e alvo de novas investigações.[23]
Em 1973, Linus Pauling fundou, juntamente com dois colegas seus, o Instituto de Medicina Ortomolecular em Menlo Park. Neste instituto, cujo nome foi alterado, de seguida, para Instituto Linus Pauling de Ciência e Medicina, Pauling continuou a dirigir investigações sobre a vitamina C, mas também manteve o seu interesse em trabalhos de química e física teórica, até à sua morte em 1994. Durante os seus últimos anos de vida, interessou-se particularmente no possível papel que a vitamina C teria na prevenção da arterioesclerose, tendo publicado três artigos sobre o uso da vitamina C e da lisina, usadas para o alívio da angina de peito. Em 1996, dois anos depois da sua morte, o instituto mudou as suas instalações para Corvallis (Oregon), para formar parte da Universidade Estadual do Oregon. No instituto realizam-se investigações sobre micronutrientes, fitonutrientes e outras maneiras de prevenir e tratar doenças através da dieta humana.
Devido à sua insistência em promover o uso da Vitamina C para finalidades carentes de evidência científica de eficácia, Pauling é algumas vezes citado como um dos exemplares de casos da Doença do Nobel.[24][25][26]
Ativismo político
[editar | editar código-fonte]Pauling não exercera qualquer ativismo político até à Segunda Guerra Mundial, mas este conflito mundial mudou a sua vida profundamente, tornando-se ativista pela paz. Por altura do início do Projecto Manhattan, que levaria ao fabrico da primeira bomba atómica, Pauling recebeu uma oferta de Robert Oppenheimer, para encabeçar o departamento de química do projecto. Pauling recusou a proposta. Em 1946, juntou-se ao Comité Emergencial de Cientistas Atómicos, dirigido por Albert Einstein. A missão deste comité era alertar o público para os perigos associados ao desenvolvimento de armas nucleares. O ativismo de Pauling levou ao confisco de seu passaporte em 1952, quando se dirigia para um congresso em Londres. O passaporte foi restaurado em 1954, pouco antes de se deslocar a Estocolmo, a fim de receber o Prémio Nobel. No ano seguinte, Linus Pauling assinou o Manifesto Russell-Einstein, juntando o seu nome ao de Bertrand Russell, Albert Einstein e outros oito cientistas e intelectuais, que apelavam para a busca de soluções pacíficas durante a Guerra Fria.
Dois anos depois, Pauling redigiu uma petição com o biólogo Barry Commoner. Este tinha estudado a presença de estrôncio-90 radioativo nos dentes de leite de crianças dos Estados Unidos, concluindo que os testes nucleares na atmosfera tinham riscos para a saúde pública, em forma de precipitação radioativa. Também participou num debate público com o físico atómico Edward Teller, sobre os riscos reais de mutações genéticas provocadas por estas precipitações.
Em 1958, Pauling e a sua esposa apresentaram, perante a Organização das Nações Unidas uma carta assinada por mais de 11 mil cientistas, pedindo a suspensão dos testes nucleares. A pressão da opinião pública conduziu a uma moratória relativa a teste nucleares de superfície, seguida pela assinatura do Tratado de Interdição Parcial de Ensaios Nucleares, por 113 países, em 5 de Agosto de 1963. Entre os subscritores, estavam John F. Kennedy pelos Estados Unidos e Nikita Khrushchov pela União Soviética. O tratado entrou em vigor em Outubro desse ano. Logo após, Pauling recebeu o Nobel da Paz de 1962 (o prémio foi reservado para que a data de entrega coincidisse com a data de entrada em vigor do tratado).
....a Linus Pauling, que desde 1946 tem advogado incessantemente, não somente contra os testes nucleares, nem somente contra a proliferação das armas nucleares, nem somente contra o seu uso; mas contra qualquer forma de resolver os conflitos internacionais pela via bélica.— Descrição do Prémio, pelo Comité Nobel Norueguês
Quando foi anunciado o prémio, o Departamento de Química de Caltech, ciente das suas visões políticas, não lhe endereçou qualquer tipo de congratulação. Contrariamente, o Departamento de Biologia ofereceu-lhe uma pequena festa, demonstrando assim a sua simpatia pelo seu trabalho sobre mutações induzidas por radiação. A desaprovação institucional relacionada com o ativismo de Pauling, motivou que este renunciasse do seu posto em Caltech, no ano de 1964. Depois disso, veio a trabalhar na Universidade da Califórnia (San Diego), de 1967 a 1969 e mais tarde na Universidade de Stanford, de 1969 a 1973.
Muitos dos detractores de Pauling apreciavam o seu trabalho científico, mas estavam em desacordo com a sua posição política, chegando a vê-lo como um ingénuo porta-voz do comunismo soviético. Em 1955, Pauling foi ordenado a comparecer diante do Subcomité de Segurança Interior do Senado, que o descreveu como "a personalidade científica número um, relacionada com virtualmente todas as atividades importantes da ofensiva pacifista-comunista que existe neste país". Pauling voltou a apresentar-se a este subcomité por várias vezes mais, em especial quando enviou a sua petição contra os testes nucleares. A revista Life descreveu o Nobel da Paz atribuído a Pauling como "um estranho insulto da Noruega". Em 1970, Pauling recebeu o Prémio Lenin da Paz, na URSS.
Até ao fim da sua vida, Pauling fez-se valer da sua notoriedade como personalidade pública, para protestar contra os conflitos armados, incluindo a guerra do Vietname. Foi também um crítico do intervencionismo dos Estados Unidos na América Latina, especialmente na Nicarágua.
Prêmios e distinções
[editar | editar código-fonte]O prêmio mais notável recebido por Linus Pauling foi o Prêmio Nobel, recebendo o de Química de 1954 e o da Paz de 1962. Para além de Pauling, só mais três pessoas o receberam em mais de uma ocasião. Pauling, contudo, foi o único a tê-lo recebido individualmente das duas vezes. Para além do Nobel, foi várias vezes distinguido ao longo da sua carreira, entre as quais cabe destacar:
- 1931 Prêmio Langmuir, pela American Chemical Society
- 1933 Membro da United States National Academy of Sciences
- 1936 Membro da American Philosophical Society
- 1946 Medalha Gibbs, pela American Chemical Society, secção de Chicago
- 1947 Medalha Davy, pela Royal Society
- 1947 Membro da Royal Society, Londres
- 1951 Medalha Lewis, pela American Chemical Society, secção de Califórnia
- 1952 Medalha Pasteur, pela Sociedade Bioquímica de França
- 1954 Nobel de Química
- 1956 Medalha Avogadro, pela Academia Italiana de Ciências
- 1960 Homem do Ano, segundo a revista Time
- 1962 Prêmio Gandhi da Paz
- 1962 Nobel da Paz
- 1970 Prémio Lenine da Paz
- 1974 Medalha Nacional de Ciências
- 1977 Medalha de Ouro Lomonossov, outorgada pela Academia de Ciências da Rússia
- 1979 Primeiro agraciado com o Prêmio em Ciências Químicas NAS pela Academia Nacional de Ciências dos Estados Unidos
- 1984 Medalha Priestley pela American Chemical Society
Legado
[editar | editar código-fonte]
A contribuição de Linus Pauling para o desenvolvimento científico no século XX é de especial importância. Pauling integrou uma lista com os vinte maiores cientistas de todos os tempos, segundo a revista britânica New Scientist. Pauling é, a par de Albert Einstein, a única personalidade do século XX a aparecer na dita lista. Gautam R. Desiraju, autor de Ensaio do Milénio, na revista Nature (PMID 11100703), descreveu Pauling como um dos maiores pensadores e visionários do milénio, juntamente com Galileu, Newton e Einstein.[27] Outro aspecto de relevo em Pauling é a diversidade de suas investigações. Pauling moveu-se em diversas áreas, fazendo contribuições importantes em Mecânica Quântica, Química Quântica, Química Inorgânica, Química Orgânica, Bioquímica, Biologia Molecular e Medicina, trazendo contribuições especialmente significativas nas fronteiras entre as ditas áreas. As suas investigações sobre a natureza das ligações químicas marcaram o início da Química Quântica, e muitos conceitos inovadores, como a hibridização de orbitais atómicas e a electronegatividade, fazem parte das bases da Química moderna, ainda que a teoria da hibridização fosse substituída pela teoria de orbitais moleculares de Robert Mulliken. Ainda que a teoria de Pauling falhasse ao não descrever quantitativamente algumas das características moleculares, como a natureza paramagnética do oxigénio, ou a cor dos compostos organometálicos, a sua simplicidade fez com que perdurasse nos livros de química. O trabalho de Pauling sobre a estrutura cristalina contribuiu para o avanço na predição e entendimento das estruturas dos minerais. As suas descobertas sobre a alfa-hélice e a folha-beta estabeleceram a base para a compreensão e estudo da estrutura das proteínas. Na sua época, Pauling era comumente chamado de pai da Biologia Molecular. Desde a altura em que Pauling entendeu que a anemia falciforme era uma enfermidade com bases moleculares, abriram-se as portas para o exame das mutações genéticas a um nível molecular.
Ainda que grande parte da comunidade científica não comungasse com as conclusões de Pauling nas suas investigações médicas a respeito do consumo de vitaminas, a participação de Pauling na polémica levou o público a sensibilizar-se para a importância do consumo de vitaminas e minerais na prevenção de doenças. A firme posição de Pauling nesta controvérsia, ajudou também a redobrar os esforços que outros investigadores dedicaram a este campo, incluindo os que laboram no Instituto Linus Pauling, onde uma dezena de investigadores e académicos exploram a importância dos micronutrientes na saúde humana.
Publicações
[editar | editar código-fonte]Livros
[editar | editar código-fonte]- ——; Wilson, E. B. (1985) [1935]. Introduction to Quantum Mechanics with Applications to Chemistry. [S.l.]: Reimpresso por Dover Publications. ISBN 978-0-486-64871-2
- —— (1939). The Nature of the Chemical Bond and the Structure of Molecules and Crystals. [S.l.]: Cornell University Press
- —— (1947). General Chemistry: An Introduction to Descriptive Chemistry and Modern Chemical Theory. [S.l.]: W. H. Freeman
- Revisado e ampliado em 1947, 1953 e 1970. Reimpresso por Dover Publications em 1988.
- ——; Hayward, Roger (1964). The Architecture of Molecules. Proceedings of the National Academy of Sciences of the United States of America. 51. San Francisco: Freeman. pp. 977–84. ISBN 978-0-7167-0158-3. PMC 300194
 . PMID 16591181. doi:10.1073/pnas.51.5.977
. PMID 16591181. doi:10.1073/pnas.51.5.977
- —— (1958). No more war!. [S.l.]: Dodd, Mead & Co. ISBN 978-1-124-11966-3
- —— (1977). Vitamin C, the Common Cold and the Flu. [S.l.]: W.H. Freeman. ISBN 978-0-7167-0360-0
- —— (1987). How to Live Longer and Feel Better. [S.l.]: Avon. ISBN 978-0-380-70289-3
- Cameron, E.; —— (1993). Cancer and Vitamin C: A Discussion of the Nature, Causes, Prevention, and Treatment of Cancer With Special Reference to the Value of Vitamin C. [S.l.]: Camino. ISBN 978-0-940159-21-1
- —— (1998). Linus Pauling On Peace: A Scientist Speaks Out on Humanism and World Survival. [S.l.]: Rising Star Press. ISBN 978-0-933670-03-7
- Hoffer, Abram; —— (2004). Healing Cancer: Complementary Vitamin & Drug Treatments. Toronto: CCNM Press. ISBN 978-1-897025-11-6
- Ikeda, Daisaku; —— (2008). A Lifelong Quest for Peace: A Dialogue. Richard L. Gage (ed., trans.). Londres: I. B. Tauris. ISBN 978-1-84511-889-1
Artigos
[editar | editar código-fonte]- —— (1927). «The Theoretical Prediction of the Physical Properties of Many-Electron Atoms and Ions. Mole Refraction, Diamagnetic Susceptibility, and Extension in Space». Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 114 (767): 181–211. Bibcode:1927RSPSA.114..181P. doi:10.1098/rspa.1927.0035

- —— (1929). «The Principles Determining the Structure of Complex Ionic Crystals». Journal of the American Chemical Society. 51 (4): 1010–1026. doi:10.1021/ja01379a006
- —— (1931). «The Nature of the Chemical Bond. I. Application of Results Obtained from the Quantum Mechanics and from a Theory of Paramagnetic Susceptibility to the Structure of Molecules». Journal of the American Chemical Society. 53 (4): 1367–1400. doi:10.1021/ja01355a027
- —— (1931). «The Nature of the Chemical Bond. II. The One-Electron Bond and the Three-Electron Bond». Journal of the American Chemical Society. 53 (9): 3225–3237. doi:10.1021/ja01360a004
- —— (1932). «The Nature of the Chemical Bond. III. The Transition from One Extreme Bond Type to Another». Journal of the American Chemical Society. 54 (3): 988–1003. doi:10.1021/ja01342a022
- —— (1932). «The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms». Journal of the American Chemical Society. 54 (9): 3570–3582. doi:10.1021/ja01348a011
- ——; Wheland, G. W. (1933). «The Nature of the Chemical Bond. V. The Quantum-Mechanical Calculation of the Resonance Energy of Benzene and Naphthalene and the Hydrocarbon Free Radicals» (PDF). The Journal of Chemical Physics. 1 (6). 362 páginas. Bibcode:1933JChPh...1..362P. doi:10.1063/1.1749304. Cópia arquivada (PDF) em 9 de outubro de 2022
- —— (1935). «The Structure and Entropy of Ice and of Other Crystals with Some Randomness of Atomic Arrangement». Journal of the American Chemical Society. 57 (12): 2680–2684. doi:10.1021/ja01315a102
- —— (1940). «A Theory of the Structure and Process of Formation of Antibodies*». Journal of the American Chemical Society. 62 (10): 2643–2657. doi:10.1021/ja01867a018
- —— (1947). «Atomic Radii and Interatomic Distances in Metals». Journal of the American Chemical Society. 69 (3): 542–553. doi:10.1021/ja01195a024
- ——; Itano, H. A.; Singer, S. J.; Wells, I. C. (1949). «Sickle Cell Anemia, a Molecular Disease». Science. 110 (2865): 543–548. Bibcode:1949Sci...110..543P. PMID 15395398. doi:10.1126/science.110.2865.543
- ——; Corey, R. B.; Branson, H. R. (1951). «The structure of proteins: Two hydrogen-bonded helical configurations of the polypeptide chain». Proceedings of the National Academy of Sciences. 37 (4): 205–11. Bibcode:1951PNAS...37..205P. PMC 1063337
 . PMID 14816373. doi:10.1073/pnas.37.4.205
. PMID 14816373. doi:10.1073/pnas.37.4.205
Bibliografia
[editar | editar código-fonte]- Cruz-Garritz, D., Chamizo, J.A., Garritz, A. Estructura atómica. Addison-Wesley Iberoamericana, Wilmington, EE.UU., 1987. ISBN 0-201-64018-X
- Hager, Thomas. Force of Nature : The Life of Linus Pauling. Simon & Schuster, 1995. ISBN 0-684-80909-5
- Hager, Thomas. Linus Pauling and the Chemistry of Life, Oxford University Press, 2000. ISBN 0-19-513972-0
- Mead, Clifford; Hager, T. Linus Pauling : Scientist and Peacemaker, Oregon State University Press, 2001. ISBN 0-87071-489-9
- Marinacci, Barbara (ed.). Linus Pauling in His Own Words: Selections from His Writings, Speeches, and Interviews, Touchstone Books, 1995. ISBN 0-684-81387-4
- Goertzel, T., et al. Linus Pauling: A Life in Science and Politics, HarperCollins Publishers, 1996. ISBN 0-465-00673-6
- Serafini, A. Linus Pauling : A Man and His Science, iUniverse, 2000. ISBN 0-595-00101-7
- Bouguerra, Mohamed Larbi (dir.), Linus Pauling, Berlin, 2002. ISBN 2-7011-2658-4
Referências
- ↑ a b c d e f g Biografia de Linus Pauling, em Nobelprize.org
- ↑ Barth, John Simmons (2010). Os 100 Maiores Cientistas da História 5ª ed. Rio de Janeiro - RJ: DIFEL. 115 páginas
- ↑ The crystal structure of molybdenite J. Am. Chem. Soc., 45, 6, pp. 1466–1471, 1923.
- ↑ Cronologia da vida de Pauling, pela Universidade Estatal de Oregon.
- ↑ O carbono tem a capacidade de formar quatro ligações de cada vez. Matematicamente, não se encontrava o mecanismo pelo qual seis átomos de carbono, que têm uma capacidade total de formar 24 ligações, se poderiam unir a seis átomos de hidrogénio, que têm uma capacidade de formar apenas seis ligações no total.
- ↑ Facsimile do caderno.
- ↑ Facsímile da publicação na revista Proc. Natl. Acad. Sci Arquivado em 9 de julho de 2007, no Wayback Machine., 54, 4, pp. 989-994, 1965.
- ↑ Descrição do modelo Arquivado em 18 de março de 2007, no Wayback Machine..
- ↑ Este evento marcou o início da época conhecida como Macartismo, nos Estados Unidos.
- ↑ Pauling, L. et al. Science 110, 543-8 (1949) PMID 15395398
- ↑ Cassileth BR. Alternative medicine handbook: the complete reference guide to alternative and complementary therapies. W.W. Norton & Co., Nova York, 1998:67.
- ↑ «"Vitamin Therapy, Megadose / Orthomolecular Therapy" Servicios de Salud Provincial de la Columbia Británica, 2000». Consultado em 10 de julho de 2007. Arquivado do original em 2 de fevereiro de 2007
- ↑ Barrett, Stephen. The Dark Side of Linus Pauling's Legacy (O lado obscuro do legado de Linus Pauling).
- ↑ Dunitz, J. D. (1 de novembro de 1996). «Linus Carl Pauling. 28 February 1901-19 August 1994». Biographical Memoirs of Fellows of the Royal Society (em inglês). 42 (0): 316-338. doi:10.1098/rsbm.1996.0020
- ↑ Publicaciones de Cameron, en doctoryourself.com.
- ↑ O website quackwatch.org apresentou uma análise de Charles W. Marshall, de 1997, negando os efeitos da vitamina C.
- ↑ Plos Arquivado em 27 de abril de 2006, no Wayback Machine. publica um estudo australiano de 2005, que confirma os efeitos benéficos da vitamina C.
- ↑ WebMD, num estudo de 2007, mostra os efeitos curativos que a vitamina C têm sobre as células imunitárias.
- ↑ Padayatty et al., na revista Canadian Medical Association Journal (CMAJ), Março de 2006 Arquivado em 6 de fevereiro de 2010, no Wayback Machine..
- ↑ As publicações no website do centro The Bright Spot For Health Arquivado em 9 de fevereiro de 2007, no Wayback Machine. mostram que a vitamina C teve efeitos positivos na luta contra o cancro.
- ↑ Artigo na National Academy of Sciences, a favor do uso da vitamina C como arma contra as células cancerígenas.
- ↑ Resumo da controvérsia.
- ↑ Estudos em progresso.
- ↑ Basterfield, Candice; Lilienfeld, Scott; Bowes, Shauna; Costello, Thomas (2020). «The Nobel disease: When intelligence fails to protect against irrationality». Skeptical Inquirer. 44: 32–37. Consultado em 6 de agosto de 2021
- ↑ Gorski, David (18 de agosto de 2008). «High dose vitamin C and cancer: Has Linus Pauling been vindicated?». Science Based Medicine. sciencebasedmedicine.org. Consultado em 13 de maio de 2020
- ↑ Gorski, David (4 de junho de 2012). «Luc Montagnier and the Nobel Disease». Science Based Medicine. sciencebasedmedicine.org. Consultado em 13 de maio de 2020
- ↑ Desiraju, G.R. Nature 408, 407 (2000) PMID 11100703
Ligações externas
[editar | editar código-fonte]- Linus Pauling (em inglês) no Mathematics Genealogy Project
- Publicações científicas selecionadas, em formato PDF
- «Perfil no sítio oficial do Nobel de Química 1954» (em inglês)
- «Perfil no sítio oficial do Nobel da Paz 1962» (em inglês)
| Precedido por Hermann Staudinger | Nobel de Química 1954 | Sucedido por Vincent du Vigneaud |
| Precedido por Dag Hammarskjöld | Nobel da Paz 1962 | Sucedido por Comitê Internacional da Cruz Vermelha e Federação Internacional das Sociedades da Cruz Vermelha e do Crescente Vermelho |


 French
French Deutsch
Deutsch

