Проміжні філаменти — Вікіпедія
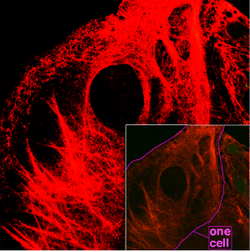
Проміжні філаменти — це елементи цитоскелету, нерозчинні білкові фібрили діаметром від 8 до 12 нм. Таким чином вони тонші за мікротрубочки (25 нм) і товстіші за актинові філаменти (7 нм), за що і отримали свою назву[1]. Проміжні філаменти складаються із різних білків, але всі вони мають спільний загальний план будови. Ці елементи цитоскелету забезпечують клітині механічну стійкість, беруть участь у формуванні міжклітинних контактів: десомосом та гемідесмосом, закріплюють окремі частини клітини (наприклад ядро) у певному положенні в цитоплазмі, також входять до складу ядерної ламіни (пластинки). На відміну від мікротрубочок і мікрофіламентів проміжіні філаменти не беруть участі у внутрішньоклітинному транспорті, не можуть приєднувати нуклеотидтрифосфати, і є відносно статичними структурами[2].
Існують два основні типи проміжних філаментів: цитоплазматичні та ядерні, котрі входять до складу ядерної ламіни. Білки ламіни еволюційно більш древні, вони наявні у всіх багатоклітинних тварин, тоді як цитоплазматичні філаменти присутні в клітинах тільки деяких, таких як нематоди, молюски та хордові. Імовірно, впродовж еволюції тварин, гени білків ядерної пластинки кілька разів дуплікувались, і з їх копій утворювались гени білків цитоплазматичих філаментів. Навіть у тих ораганізмів, що мають такі гени, вони експресуються не у всіх клітинах, наприклад клітини мікроглії людини (олігодендроцити) позбавлені проміжних філаментів. Оскільки основна функція цитоплазматичних проміжних філаментів — забезпечувати механічну стійкість, вони найбільш розповсюджені у тих клітинах, які постійно піддаються розтягу та тиску (наприклад епітеліальних). У тварин із міцним езкоскелетом, наприклад членистоногих та голкошкірих, цитопламзатичні проміжні філаменти відсутні[3], також вони не знайдені й у клітинах рослин, які мають міцну клітинну стінку[4].

На відміну від інших елементів цитоскелету, ідентичних у всіх типах клітин, проміжні філаменти можуть складатись із різних білків, проте всі вони мають однакові домени і схожу структуру, завдяки чому зберігається загальний план будови проміжних філаментів. Мономерний білок проміжних філаментів — це фібрилярна структура довжиною 48 нм, центральний домен якої представлений довгою α-спіраллю.
Два мономерні білки взаємодіють між собою, утворюючи димер, в якому вони розташовані паралельно (C-кінець до C-кінця), α-спіральні домени закручені один навколо одного, утворюючи подвійну суперспіраль[en]. Два димери, розташовані антипаралельно (C-кінець до N-кінця) утворюють тетрамер. Такий тетрамер і є основною розчинною білковою одиницею, з якої збираються проміжні філаменти. На відміну від структурних компонентів мікротрубочок та актинових філаментів, тетрамери проміжних філаментів не мають сайтів для зв'язування нуклеотидтрифосфатів, окрім того вони мають два однакові кінці, через що проміжні філаменти позбавлені полярності. Тетрамери взаємодіють латерально (бік до боку), утворюючи фібрилу, що складається з 8-ми паралельних протофібрил. Отже кожен філамент у перерізі містить 32 α-спіралі, з'єднані одна з одною гідрофобними зв'язками. Через це проміжні філаменти за властивостями схожі до каната: вони мають дуже високу міцність на розрив але легко згинаються (для того, щоб проміжний філамент можна було зігнути, він повинен мати довжину хоча б 1 мкм, тоді як для актинових філаментів ця довжина становить 10 мкм, а для мікротрубочок — кілька міліметрів)[3].
Всі білки, які входять до складу проміжних філаментів, мають однакову структуру центрального домену, що складається із близько сорока повторів по сім неполярних амінокислот[5], тоді як N- і C-кінцеві ділянки у них можуть суттєво відрізнятись. В залежності від амінокислотного складу і структури розрізняють п'ять основних типів білків проміжних філаментів, коротка характеристика та приклади яких наведені у таблиці.

| Основні типи білків проміжних філаментів[3][5] | ||
|---|---|---|
| Тип проміжних філаментів | Поліпептиди, що входять до їх складу | Клітини, в яких зустрічаються |
| Тип І та ІІ (епітеліальні) | Кератини першого типу (кислі) | Епітеліальні клітини та їх похідні (нігті, волосся) |
| Кератини другого типу (основні/нейтральні) | ||
| Тип ІІІ (віментиноподібні) | Віментин | Багато клітин мезенхімального походження |
| Десмін | М'язи | |
| Гліальний фібрилярний кислий білок | Гліальні клітини (астроцити, деякі Шваннівські клітини)| | |
| Периферин | Периферійні нейрони | |
| Тип IV (аксональні) | Білки нейрофіламентів (NF-L, NF-M, NF-H) | Нейрони |
| Тип V (ядерні) | Ламіни A, C, B1 і B2 | У всіх типів клітин входять до складу ядерної ламіни |
| Некласифіковані | Факінін, філензин | Цитоплазма клітин кришталика |

Кератини є найрізноманітнішою групою білків, з яких побудовані проміжні філаменти: у людських епітеліальних клітинах знайдено близько 20 різних типів, і ще 10 специфічні для нігтів та волосся. Аналіз геному людини виявив близько 50 генів кератинів. Різні типи кератинів експресуються у різних епітеліальних клітинах організму, ця особливість використовується під час діагностики карцином (злоякісних пухлин епітеліального походження).
В епітеліальних клітинах утворюються цілі сітки кератинових філаментів, в яких вони з'єднуються одне з одним за допомогою дисульфідних зв'язків. Такі сітки дуже стійкі і не розпадаються навіть після смерті клітини, тому кератини використовуються тваринами для утворення покривів тіла, таких як зовнішній шар шкіри, нігті, волосся, луски. Окрім того кератинові філаменти надають міцності епітелію, беручи участь в утворенні якірних міжклітинних контактів — десмосом, або контактів клітини із позаклітинною матрицею — гемідесмосом[3].
Кілька спадкових захворювань людини виникають внаслідок мутацій у генах кератинів. Зокрема такою хворобою є простий бульозний епідермоліз[en][6], за якого навіть при незначному механічному подразненні базальний шар шкіри розривається і утворюються водяні пухирі. Існують також хвороби, при яких пухирі можуть утворюватись у роті, стравоході, на рогівці ока[3].
Віментиноподібні білки можуть утворювати гомо- або гетерополімери, вони поширені у різних групах клітин. Деякі з них, наприклад віментин у фібробластах, можуть формувати дуже динамічні структури, котрі збираються/розбираються внаслідок дефосфорилювання/фосфорилювання.
До цього класу білків також належить десмін, який експресується у скелетних, серецевому та гладеньких м'язах. У мишей із нокаутним геном десміну, м'язи спочатку розвиваються нормально, але в дорослому віці у них спостерігається багато порушень, зокрема неправильне розташування м'язових волокон.

Нейрофіламенти — це тип проміжних філаментів, що створюють каркас аксонів нервових клітин херебетних тварин. До їх складу входять три основні білки, які називаються (на основі молекулярної маси): NF-L (англ. neurofilament light), NF-M (англ. neurofilament medium) та NF-H (англ. neurofilament heavy), при чому кожен філамент є гетерополімером із білка NF-L та одного із двох інших. Білки NF-M та NF-H мають довгі C-термінальні домени, якими вони приєднуються до сусідніх нейрофіламентів, таким чином між окремими філаментами зберігається однакова відстань. Коли аксон росте нейрофіламенти добудовуються на обидвох кінцях.
Під час нейродегенеративного захворювання бічного аміотрофічного склерозу у тілах та аксонах мотонейронів накопичуються нейрофіламенти неправильної структури. Це призводить до порушення аксонального транспорту та, згодом до дегенерації мотонейронів, слабкості та атрофії м'язів, яка, зазвичай, є летальною. Оверекспресія людських генів NF-L та NF-H в організмі мишей призводить до виникнення у них захворювання схожого до бічного аміотрофічного склерозу[3].
Ядерна пластинка або ламіна знаходиться на внутрішній мембрані ядерної оболонки і складається із білків ламінів, організованих у двомірну сітку. Ця стурктура утворює комплекси із ядерними порами та трансмембранними білками, а також безпосередньо взаємодіє із перефирійним хроматином. Основна функція ядерної ламіни — підтримання форми ядра. До складу ядерної пластинки входять три основні поліпептиди ламіни A, B і C (молекулряні маси 60-70 кДа).
Ядерна пластинка є динамічною структурою, під час мітозу, коли оболонка ядра розпадається, білки ламіни фосфорилюються і це призводить до їх деполімеризації. У ранній телофазі ці поліпептиди дефосфорилюються і знову утворюють довгі фібрили, після чого беруть участь в організації нової ядерної оболонки[3].
- ↑ Campbell NA, Reece JB (2008). Biology (вид. 8th). Benjamin Cammings. ISBN 978-0321543257. Архів оригіналу за 3 березня 2011. Процитовано 17 липня 2011.
- ↑ Marieb EN, Hoehn K (2006). Human Anatomy & Physiology (вид. 7th). Benjamin Cummings. ISBN 978-0805359091.
- ↑ а б в г д е ж Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
- ↑ Ченцов Ю.С. ВВедение в клеточною биологию: Учебник для вузов. — 4-е изд. перераб. и доп./ Ю.С.Ченцов. — М.: ИКЦ «Академкнига», 2004. — 495с.: ил. ISBN 5-94628-105-4
- ↑ а б Strelkov SV, Herrmann H, Aebi U (2003). Molecular architecture of intermediate filaments. BioEssays. 25: 243—251. doi:10.1002/bies.10246. PMID 12596228.
- ↑ Медстандарт.net
- Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). Molecular Cell Biology (вид. 4th). W. H. Freeman. ISBN 0-7167-3136-3.
- Coulombe PA, Wong P (2004). Cytoplasmic intermediate filaments revealed as dynamic and multipurpose scaffolds. Nature Cell Biology. 6: 699—706. doi:10.1038/ncb0804-699. PMID 15303099.
- Eriksson JE, Dechat T, Grin B, Helfand B, Mendez M, Pallari HM, Goldman RD (2009). Introducing intermediate filaments: from discovery to disease. J Clin Invest. 119: 1763—71. doi:10.1172/JCI38339. PMID 19587451.
- Відео: Intermediate Filaments (Проміжні філаменти) із Essential Cell Biology, 3rd Edition Alberts, Bray, Hopkin, Johnson, Lewis, Raff, Roberts, & Walter (англ.)


 French
French Deutsch
Deutsch