Żaba trawna – Wikipedia, wolna encyklopedia
| Rana temporaria | |||||
| Linnaeus, 1758 | |||||
 | |||||
| Systematyka | |||||
| Domena | |||||
|---|---|---|---|---|---|
| Królestwo | |||||
| Typ | |||||
| Podtyp | |||||
| Gromada | |||||
| Rząd | |||||
| Podrząd | |||||
| Rodzina | |||||
| Rodzaj | |||||
| Gatunek | żaba trawna | ||||
| |||||
| Podgatunki[2] | |||||
| |||||
| Kategoria zagrożenia (CKGZ)[3] | |||||
 | |||||
| Zasięg występowania | |||||
 | |||||
Żaba trawna (Rana temporaria) – gatunek płaza bezogonowego z rodziny żabowatych (Ranidae). Podobnie jak żaba dalmatyńska i żaba moczarowa należy do tzw. żab brunatnych, która to nazwa bierze się od koloru skóry tych zwierząt. Gatunek posiada szeroki zasięg występowania, obejmujący większą część Europy (w tym północne wybrzeża kontynentu) i zachodnią Azję. Zasiedla różnorodne siedliska klimatu umiarkowanego, zwłaszcza lasy. Rozmnaża się w płytkich zbiornikach wodnych. Duży wpływ na rozród wywiera temperatura, swój udział mają też szerokość geograficzna i drapieżnictwo. W rozwoju występuje stadium kijanki żywiącej się roślinami wodnymi, glonami i drobnymi zwierzętami wodnymi. Osobniki dorosłe są mięsożerne, poza sezonem rozrodczym wiodą lądowy tryb życia, polując zmierzchem i nocą. Zdarzają się przypadki zmiany płci. Ten pospolity płaz nie jest zagrożony wyginięciem, pomimo to figuruje w licznych Czerwonych Księgach i Listach. Negatywny wpływ wywierają nań m.in. zanieczyszczenie środowiska i fragmentacja siedlisk.
Taksonomia i klasyfikacja
[edytuj | edytuj kod]Autorem uznawanej nazwy taksonomicznej jest Karol Linneusz. W swym dziele Systema Naturae wśród cech taksonomicznych zwrócił uwagę m.in. na palce płaza[4]. Nazwa gatunkowa zwierzęcia posiada liczne synonimy, między innymi Rana aragonensis Palanca-Soler, Vieites & Martínez-Suárez, 1995, którą uznano za tożsamą z żabą trawną w 2003 (Veith et al.)[1]. Do 2020 roku za podgatunek żaby trawnej uznawano Rana parvipalmata z północno-zachodniej Hiszpanii, klasyfikowaną obecnie jako odrębny gatunek na podstawie badań genetycznych[5][6].
Wraz z żabą moczarową i dalmatyńską należy do żab brunatnych[7]. Pod względem ekologii wykazuje duże podobieństwo do pierwszej z wymienionych i prawdopodobnie z nią konkuruje w środowisku naturalnym[8].
W języku angielskim jako określenie gatunku funkcjonuje także nazwa European red frog[9].
Budowa ciała
[edytuj | edytuj kod]

Osiąga 7–9, rzadziej 11 cm długości[10]. Największe rozmiary cechują osobniki z umiarkowanych szerokości geograficznych, przerastające płazy z południa i północy, mimo że to wśród tych ostatnich najwyższa jest średnia wieku, dodatnio korelującego z wielkością. Geny odpowiadają za tę zmienność tylko częściowo[11].
Poszczególne osobniki żaby trawnej różnią się od siebie ubarwieniem. Gładka skóra tego gatunku obfituje w chromatofory[12]. Ich grzbiety mogą przybierać barwy różnych odcieni brązu (szarobrązowe, oliwkowobrązowe), żółci, szarości, spotyka się też oliwkowe i rudawe. Grzbiet i boki pokrywa drobne[13] lub większe ciemne plamkowanie[10]. Od oka do nasady kończyn przebiega trójkątna ciemnobrunatna plama skroniowa[14]. Szyję zdobi ciemna plama w kształcie litery V[13]. Tylne łapy zdobią poprzeczne pasy[10]. Brzuszna strona ciała przyjmuje kolory białe, żółtawe i szarawe z plamkowaniem brązowym, brązowoszarym lub czarnym[13].
Głowa jest mała[14]. Źrenica oka leży horyzontalnie. Pysk określa się jako zaokrąglony[13], krótki i tępy[10] lub szeroki, ostro zakończony[14] (zaostrzeniu pyska jedne źródła przeczą[10], a z innych wynika, że jest bardziej zaostrzony niż u żab zielonych[12]). Tylna część języka jest wolna i rozwidlona. Występują zęby lemieszowe[13].
Ciało jest korpulentne[13], wydłużone, krępe[12]. Mostek i omosternum są skostniałe[13].
Stosunek długości ciała do długości goleni wynosi 1,76–2,0. Gdy płaz ustawia swe długie, silne, zdolne do wykonywania dalekich skoków[12] tylne łapy wzdłuż ciała, staw skokowy górny znajduje się w okolicy oka[13]. Nigdy nie sięga jednak końca pyska[10]. Wewnętrzny guzek śródstopia jest krótszy od pierwszego palca 2,2–4,4 raza. Palce spaja błona pławna[13], niezbyt silnie rozwinięta[12].
Obserwuje się dymorfizm płciowy. Samice osiągają większą długość ciała niż płeć przeciwna. Różnice te zmniejszają się z wiekiem[15]. U samców występują wewnętrzne parzyste worki rezonansowe, a także opuszki na pierwszym palcu. Podczas sezonu godowego ich podgardle przybiera barwę niebieskawą. Wtedy też samce ubarwione są jasno, szarawo, samice zaś brązowo i rudo[13].
Fizjologia
[edytuj | edytuj kod]Skóra żaby trawnej wydziela peptydy temporyny o działaniu antybakteryjnym przeciwko bakteriom Gram(+). Złożone z 10–13 reszt aminoacylowych, stanowią najmniejsze dotąd poznane naturalne antybakteryjne peptydy. Przypominają one budową podobne związki o właściwościach hemolitycznych, same takich nie posiadają[16].
Badania poziomu cukru we krwi, glikogenu wątrobowego i tłuszczu oraz gonad wykazały, że zmieniają się one w zależności od pory roku. U osobników, które wkroczyły już w okres godowy, choćby w marcu, a także w czerwcu, lipcu i listopadzie, odnotowano wysoki poziom cukru: 54–62 mg/100 ml. Hiperglikemia wiąże się z szybkim rozwojem tkanki tłuszczowej, po czym następuje rozwój gonad, kiedy to cukier spada do około 40 mg%. Wzrasta ponownie pod koniec regeneracji gonad, kiedy to zwraca uwagę głównie synteza glikogenu w wątrobie. W czasie godów odnotowano hiperglikemię wiążącą się z gwałtownym uszczupleniem rezerw energetycznych. Po sezonie godowym w kwietniu i maju cukier utrzymuje się na niskim poziomie, nie występuje akumulacja rezerw energetycznych. Organizm płaza naprawia uszkodzenia, prawdopodobnie rośnie. W zimie glukoza ponownie obniża się do 40 mg%. Organizm korzysta wtedy ze zgromadzonych rezerw glikogenu i tłuszczu. Zaobserwowano także dymorfizm płciowy: od czerwca do września wyższy poziom cukru cechuje samice, od września do stycznia – samce. Różnice te łączy się z odmiennym tempem regeneracji gonad u obu płci[17]. Poza tym samce dysponują większymi rezerwami niż samice. Różnice pomiędzy płciami w tym zakresie maleją (a same rezerwy rosną) w miarę poruszania się na północ[18].
Występowanie
[edytuj | edytuj kod]
Płaz posiada bardzo szeroki zasięg występowania, obejmujący większą część Europy i przyległe rejony Azji. Na północy sięga Norwegii, Finlandii i Federacji Rosyjskiej, dochodząc na wschodzie Norwegii do północnego wybrzeża kontynentu[3] (północne wybrzeże Morza Białego, południowe – Morza Barentsa[13], jest to jedyny płaz Przylądka Północnego[12]). Na południu osiąga północną Hiszpanię, granica jego zasięgu przebiega jednak na północ od Portugalii. Sięga północnych Włoch, na górzystych terenach Bałkanów występują rozsiane populacje. Na zachodzie zwierzę sięga Irlandii, na wschodzie zaś azjatyckich ziem Federacji Rosyjskiej i północnego Kazachstanu[3]. Dokładniej granica zasięgu przebiega na Ukrainie wzdłuż linii: obwód odeski – obwód mikołajowski – obwód kirowohradzki – obwód zaporoski, po czym zmierza na północ do obwodów dniepropetrowskiego i charkowskiego. W Federacji Rosyjskiej granica przebiega przez następujące obwody: obwód biełgorodzki, obwód woroneski, obwód tambowski, obwód penzeński, obwód uljanowski, obwód samarski, obwód orenburski, po czym wstępuje do Kazachstanu, skąd mniej więcej południkowo kieruje się na północ[13].
Obszar zasięgu obejmuje następujące państwa[3]: Albania, Andora, Austria, Białoruś, Belgia, Bułgaria, Chorwacja, Czarnogóra, Czechy, Dania, Finlandia, Francja, Grecja, Hiszpania, Holandia, Irlandia, Liechtenstein, Luksemburg, Macedonia, Niemcy, Norwegia, Polska, Rumunia, San Marino, Serbia, Słowacja, Słowenia, Szwajcaria, Szwecja, Ukraina[13], Węgry, Wielka Brytania, Włochy. Wedle niektórych źródeł płaza spotyka się też w Chinach[13] i Japonii[13][10].
Sądzi się, że w Europie Środkowej gatunek ten rozprzestrzenił się w plejstocenie[12].
Siedlisko
[edytuj | edytuj kod]Żaba trawna żyje w klimacie umiarkowanym[14]. Zasiedla różnorodne habitaty, zarówno lądowe, jak i wodne. W tym pierwszym przypadku preferuje tereny leśne, przy czym bytuje w lasach liściastych, iglastych i mieszanych. Zamieszkuje też tundrę, stepy, busz i tereny porośnięte krzewami, łąki, zarówno suche, jak podmokłe, polany leśne, tereny trawiaste, bagna[3] i torfowiska[7]. Spotyka się ją też na polach, w ogrodach, parkach, nie tylko na obszarach rolniczych, ale także w miastach[3]. W górach sięga aż do hal i turni, do wysokości 3000 m n.p.m., w Tatrach jednak tylko do 2000 m[12]. Zwierzę zajmuje też szeroki wachlarz zbiorników wodnych, tymczasowych i stałych: stawy, rzeki i jeziora, także wśród środowisk zmodyfikowanych działalnością ludzką[3]. Wydaje się, że w północnej i południowej części zasięgu występowania płaz spędza więcej czasu w wodzie. Na północy zasiedla głównie las i tundrę na obrzeżach jezior. Na południowej granicy obszaru swej bytności zajmuje tylko miejsca wilgotne, nawet bardziej niż sympatryczna z nią żaba moczarowa, choć w innych częściach zasięgu występowania to ta druga jest bardziej wilgociolubna. R. arvalis uchodzi też za bardziej ciepłolubną. Żaba trawna preferuje środowiska chłodniejsze i mniej wilgotne, a w europejskiej części Federacji Rosyjskiej także bardziej zadrzewione niż żaba moczarowa. Stosunek liczebności tych dwóch gatunków w danym terenie zmienia się z roku na rok. W centrum zasięgu występowania R. temporaria zasiedla bardziej różnorodne zbiorniki wodne niż na obrzeżach[13].
Płaz ten, swoją drogą odporny na zimno i niekorzystne warunki atmosferyczne[12], zimuje w wodzie[13], zagrzebany w mule[10]. Hibernację odbywa w rowach, źródłach, stawach, jeziorach, na mokradłach, w rzekach. W tym wypadku preferuje wody płynące. Grupuje się wtedy w duże grupy liczące nawet kilka tysięcy osobników. Okres zimowania zależy od długości i szerokości geograficznych. Rozpocząć się może od sierpnia do listopada, a skończyć od lutego do początku czerwca[13]. W Europie Środkowej żabę spotyka się od lutego do listopada[7]. W Skandynawii zachowuje ona aktywność przez 3–7 miesięcy[18].
Zachowanie i pożywienie
[edytuj | edytuj kod]Nie licząc okresu rozrodczego, płaz wiedzie lądowy tryb życia, jego aktywność przypada na zmierzch i na noc. W czasie godowym obejmuje ona także dzień[10].
Żaba trawna żywi się na lądzie, spożywając dżdżownicowate, ślimaki, owady[13] i pająki[12]. Na północy większy udział w jej jadłospisie ma zdobycz wodna: owady i mięczaki[13]. W przypadku starych, dużych osobników odnotowano zachowania kanibalistyczne w stosunku do młodych żab[12]. Na polowanie wyrusza o zmierzchu lub podczas deszczu[12]. Sama z kolei stanowi zdobycz łasicowatych. Sądzi się, że dynamika populacji tych ssaków zależy od liczebności i dynamiki populacji żab trawnej i moczarowej. Oba gatunki z rodzaju Rana łączą także podobne pasożyty[13].
Rozmnażanie
[edytuj | edytuj kod]

Rozród odbywa się od lutego[10] albo marca[13] (w Polsce od końca marca[10]) do późnego czerwca, zazwyczaj w kwietniu[13]. Przebiega w zarośniętych[10] zbiornikach wodnych o głębokości od 5 do 50 cm, jak stawy, jeziora, bagna, rowy, rzeki o wolnym nurcie[13]. R. temporaria do zbiornika rozrodu przemieszcza się od zmierzchu do północy[10]. Wedle starszych badań Juszczyka czynnikiem mającym największy wpływ na te migracje jest temperatura powietrza, nowsze zaś uznają zań temperaturę wody[19]. Samce nawołują samice odgłosem przypominającym ciche mruczenie[10][7]. Występuje ampleksus piersiowy, który może zdarzyć się także na lądzie, w drodze płazów do stawu[13].

Czas złożenia skrzeku także zależy od temperatury[20]. Zwykle wiele samic składa jaja w jednym miejscu, nieopodal brzegu zbiornika[10]. Wedle niektórych źródeł samica nie szuka sobie starannie odpowiedniego dla tego celu miejsca[12]. Skrzek ma postać galaretowatych, kulistych kłębów[10] liczących 670–4500 jaj, tworzących razem wielkie agregacje liczące nieraz setki takich pojedynczych kłębów. Minimalizuje to wahania temperatury, nieco wyższej niż otaczającej je wody i chroni przed niewielkimi drapieżnikami, zwłaszcza bezkręgowcami i traszkami. Tak więc młode są dzięki temu bezpieczniejsze, a także szybciej się rozwijają (wyjątkiem są te znajdujące się w dolnych częściach agregatu, gdyż leżące wyżej zużywają potrzebny im tlen). To właśnie stanowi przyczynę wybierania przez żabę trawną płytkich wód dla rozrodu[13]. W Tatrach odnotowano także składanie jaj w wilgotnym mchu – na lądzie w bezpośredniej bliskości zbiornika wodnego[12].

Larwy nie przypominają osobników dorosłych. Większość ich przystosowań rozwinęła się w trakcie ewolucji wtórnie, a wśród larw ich przodków podobieństwo do dojrzałych płazów było większe[21]. Żywią się detrytusem, glonami i roślinami wodnymi, w mniejszej ilości zaś pokarmem zwierzęcym. Tuż po wylęgnięciu się zjadają roztocze, skoczogonki i larwy muchówek. W miarę ich rozwoju zwiększa się różnorodność spożywanego przez nie pożywienia[13]. Ich aktywność, w tym ta poświęcona żerowaniu, koreluje dodatnio z szerokością geograficzną. Podczas gdy w obliczu drapieżnika kijanki z większości populacji zmniejszają aktywność, te z północy nadal ją zachowują. W ich wypadku zatem ceną za szybkie tempo wzrostu jest większa śmiertelność[22]. Kijanki gromadzą się w płytkiej wodzie osiągając zagęszczenie około setki larw na jeden litr wody (czasem nawet kilkaset osobników na litr). Obszar gromadzenia się zwierząt może zajmować kilkaset m². Podobnie ma się sprawa z żabkami tuż po przeobrażeniu[13].
Kijanki przeobrażają się od czerwca do sierpnia. Przechodzące metamorfozę larwy są różnej wielkości[13]. Na większej części zasięgu geograficznego drapieżnictwo negatywnie wpływa na rozmiary przeobrażających się larw[22], a nawet opóźnia czas przemiany[23]. Na północy jego efekt jest niewielki, może ono oddziaływać dodatnio na wspomnianą wielkość[22]. Metamorfozę przyśpiesza również obniżenie się poziomu wody, co ma większe znaczenie od drapieżnictwa. Jednak przeobrażające się w wysychającym zbiorniku larwy osiągają mniejsze rozmiary i są mniej aktywne[23]. Pierwsze przystępują doń większe osobniki. Wczesna metamorfoza bardziej się opłaca niż późniejsza, wiąże się bowiem z większymi szansami przetrwania zimy[13]. Skandynawskie badania wykazały, że larwy z północy w laboratorium przeobrażają się szybciej niż pochodzące z południa. W naturze jednak zależność tę zakłócają lokalne warunki, jak temperatura czy dostępność pokarmu i czas metamorfozy osobników żyjących na tej samej szerokości geograficznej różni się od siebie, nawet w przypadku niezbyt oddalonych od siebie stawów[24]. Na obszarach górskich zaobserwowano zimowanie kijanek[12]. Podczas metamorfozy nowe cechy pojawiają się zwykle przed zaniknięciem larwalnych. Mózgoczaszka zmienia się nieznacznie w przeciwieństwie do rozległych modyfikacji trzewioczaszki. Chondrocyty niszczonych wtedy chrząstek czaszki odróżnicowują się. Większość mięśni zmienia miejsce przyczepu, by sprostać nowym potrzebom, a mięśnie szczękowe i gnykowe przechodzą całkowitą zmianę: istniejące u larwy włókna mięśniowe są zastępowane przez nowe[21]. Po przeobrażeniu żabki mają 1–1,5 cm długości[10], a wedle innych danych średnio 1,61 cm[15]. W czerwcu masowo opuszczają zbiorniki wodne[10].
Dojrzałość płciową zwierzęta te osiągają nie później niż w 3. roku życia trwającego 6–8 lat, a w Uralu Polarnym nawet 17 lat[13]. Samice osiągają ją rok później niż samce. Cechuje je wobec tego w czasie dojrzewania większa masa ciała. Poza tym u samic wiek i długość ciała w czasie osiągnięcia dojrzałości korelują ze sobą w dużym stopniu, u samców takiej zależności się nie dostrzega. Osobniki o krótszym okresie aktywności rosną wolniej, ale w końcu osiągają większe rozmiary. Występuje też u nich większy dymorfizm płciowy. Przeżywalność u obu płci wynosi 0,8[15].
Genetyka
[edytuj | edytuj kod]Badania przeprowadzone w Niemczech ujawniły wyższy od wynikającego z prawa Hardy’ego-Weinberga odsetek homozygot. Wiąże się on z oddzielaniem od siebie populacji przez autostrady[25]. Wykazano także, że świadczące o zdrowiu cechy larw (jak przeżywalność, wielkość) korelują dodatnio z różnorodnością sekwencji mikrosatelitarnych w populacji. W małych populacjach dryf genetyczny odnosi w porównaniu z selekcją naturalną proporcjonalnie większy wpływ, populacje takie cechują mniejsze zróżnicowanie i gorsza kondycja. Rozdrobnienie ogranicza także potencjał adaptacyjny[26].
Nie występują dobrze rozwinięte chromosomy płci. W niektórych populacjach z determinacją płci (a ściślej z płcią męską) wiąże się mikrosatelitarny locus RtSB03, w innych zaś takiego związku się nie stwierdza[27]. Odkryto już co najmniej 3 takie markery[28]. Nie można wykluczyć, że za determinację płci odpowiadają liczne czynniki związane z różnymi chromosomami. Sytuację komplikują rekombinacje materiału genetycznego i fenotypowe zmiany płci[27]. Udokumentowano przypadki, w których samica stawała się samcem. Uważa się, że z jej związku z kolejną samicą przychodzą na świat tylko samice. W badaniach tych nie odnotowano natomiast sytuacji przeciwnej, w której samiec zmieniałby płeć. Wysunięto teorię, wedle której miałoby to na celu ochronę nieulegającego rekombinacji chromosomu Y. Spotyka się populacje ze znaczną przewagą samic, ale zjawisko zmiany płci i jednopłciowego skrzeku zdarza się zbyt rzadko i przejściowo, by zadecydować o takiej strukturze populacji[28].
Ewolucja
[edytuj | edytuj kod]Badania morfometryczne, osteologiczne i elektroforetyczne śródziemnomorskich gatunków tzw. grupy żaby trawnej (prócz wspomnianej Rana iberica, Rana cameranoi, Rana macrocnemis, Rana holtzi, Rana dalmatina, Rana graeca, Rana latastei) pozwoliły zrekonstruować drzewo rodowe tej grupy, przy czym dane elektroforetyczne okazały się do tego celu najlepsze. Zgodnie z nimi linia żaby trawnej i R. ibericae oddzieliła się od reszty w późnym plejstocenie[29].
Choroby
[edytuj | edytuj kod]Wśród drobnoustrojów nękających gatunek wymienić można wirusy Iridivirus, znalezione w wątrobie osobników cierpiących na krwotoki, którym często towarzyszą owrzodzenia. Wcześniej za związany z chorobą patogen uważano bakterię Aeromonas hydrophila, uznaną później za oportunistyczną. Ze wspomnianych osobników wyizolowano też cząstki przypominające adenowirusy[30].
Na żabach trawnych pasożytują też nicienie, jak np. Oswaldocruzia filiformis znaleziona u 64% populacji na wschodzie Irlandii. Bytuje ona w proksymalnej połowie jelita cienkiego dorosłych płazów przez cały rok. U kijanek dotychczas jej nie stwierdzono[31].
Z kolei na skórze zwierzęcia bytują pasożyty Dermocystidium ranae i Dermosporidium granulosum[32].
Status
[edytuj | edytuj kod]Występuje bardzo pospolicie[3], jest zwykle najczęściej spotykanym płazem w lasach[13], Tatrach[12] i najpospolitszą żabą Europy Środkowej[7]. W badaniach z roku 2007 przeprowadzonych w Nadmorskim Parku Krajobrazowym osobniki należące do tego gatunku stanowiły 36% spotkanych płazów[33]. Liczebność gatunku utrzymuje się na stałym poziomie pomimo pewnego spadku w Europie Zachodniej (Hiszpania, Szwajcaria)[3]. Dla przykładu w europejskiej części Rosji na 1000 m² przypada od 1 do 250 osobników[13]. Badania obejmujące razem z żabą trawną także żabę moczarową nie wykazały negatywnego wpływu dużego zagęszczenia osobników na tempo ich wzrostu czy kondycję w przypadku R. temporaria (w przeciwieństwie do drugiego objętego eksperymentem gatunku)[8].
Żabie trawnej nie zagraża wyginięcie. Niekorzystny wpływ wywierają na nią zanieczyszczenie (zwłaszcza pestycydy[7]) i osuszanie terenów, na których się rozmnaża, podobnie jak odłów, tak dla celów medycznych, spożywczych, jak i komercyjnych. Nie sprzyja jej także wylesianie, mogące stanowić przyczynę odwrotu zwierzęcia ku północy[3]. Szwedzkie badania wykazały, że stan wód (wyższe pH, przewodnictwo, stężenia azotynów i azotanów) raczej nie wpływa na rozród żaby trawnej ani moczarowej[34]. Brytyjskie badania fenologiczne stwierdziły, że współczesne zmiany klimatyczne (głównie temperatura) wpływają na czas gromadzenia się płazów i składania skrzeku, jednak nie na moment wylęgania się larw[20].
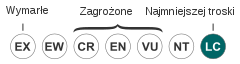
Konwencja berneńska obejmuje gatunek swym trzecim załącznikiem, natomiast dyrektywa siedliskowa Unii Europejskiej – piątym. Poza tym chroni ją ustawodawstwo wielu krajów (w Polsce objęta ochroną częściową[35])[36], płaz figuruje też w licznych czerwonych księgach i listach[3]. Wymienić tu można np. Czerwoną listę kręgowców (płazy Amphibia, gady Reptilia, ptaki Aves, ssaki Mammalia) województwa opolskiego[37]. Nie obejmuje jej za to CITES[13]. IUCN od 2004 przyznaje jej status LC (Least Concern – najmniejszej troski). W części zasięgu występowania czyni się starania mające na celu zmniejszenie ilości zwierząt zabijanych na drogach[3].
Przypisy
[edytuj | edytuj kod]- ↑ a b Darrel R. Frost, Rana temporaria Linnaeus, 1758, [w:] Amphibian Species of the World: an Online Reference. Version 6.2 [online], American Museum of Natural History, New York, USA [dostęp 2024-07-29] (ang.).
- ↑ Taxonomy – Rana temporaria (species). [w:] UniProt: the Universal Protein Knowledgebase in 2023 [on-line]. [dostęp 2024-07-29]. (ang.).
- ↑ a b c d e f g h i j k l Rana temporaria, [w:] The IUCN Red List of Threatened Species (ang.).
- ↑ Karol Linneusz: Systema naturae, per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis.. 1767, s. 357. [dostęp 2010-09-22].
- ↑ Darrel R. Frost, Rana parvipalmata López-Seoane, 1885, [w:] Amphibian Species of the World: an Online Reference. Version 6.2 [online], American Museum of Natural History, New York, USA [dostęp 2024-07-29] (ang.).
- ↑ Christophe Dufresnes i inni, Are glacial refugia hotspots of speciation and cytonuclear discordances? Answers from the genomic phylogeography of Spanish common frogs, „Molecular Ecology”, 29 (5), 2020, s. 986–1000, DOI: 10.1111/mec.15368, ISSN 0962-1083 (ang.).
- ↑ a b c d e f Wilfried Stichmann: Płazy. W: Wilfried Stichmann, Erich Kretzschmar: Zwierzęta. Warszawa: MULTICO Oficyna Wydawnicza, 1998, s. 192, seria: Spotkania z przyrodą. ISBN 83-7073-185-6.
- ↑ a b Jon Loman, Björn Lardner. Density dependent growth in adult brown frogs Rana arvalis and Rana temporaria – A field experiment. „Acta Oecologica”. 35 (3), s. 824–830, 2009-11. (ang.).
- ↑ Maurizio Slmmaco, Giuseppina Mignogna, Silvia Canofeniz, Rossella Miele, Maria Luisa Mangoni & Donatella Barra. Temporins, antimicrobial peptides from the European red frog Rana temporaria. „Eur. J. Biochem.”. 242, s. 788–792, 1996. FEBS. DOI: 10.1111/j.1432-1033.1996.0788r.x. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r Ulrich Gruber: Płazy i gady, gatunki środkowoeuropejskie. Warszawa: Multico, 1997, s. 32, seria: Świat przyrody. ISBN 83-7073-114-7.
- ↑ A.T. Laugen, A. Laurila, K.I. Jonsson, F. Soderman, J. Merila. Do common frogs (Rana temporaria) follow Bergmann’s rule?. „Evolutionary Ecology Research”. 7, s. 717–731, 2005. (ang.).
- ↑ a b c d e f g h i j k l m n o p Marian Młynarski: Płazy i gady Polski. Warszawa: Państwowe Zakłady Wydawnictw Szkolnych, 1966, s. 22.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah Sergius L. Kuzmin, Meredith J. Mahoney, Kellie Whittaker: Rana temporaria Common Frog. AmphibiaWeb, 2010-05-31. [dostęp 2010-08-24]. (ang.).
- ↑ a b c d Żaba trawna. WIEM, darmowa encyklopedia. [dostęp 2010-08-25]. [zarchiwizowane z tego adresu (2009-03-24)].
- ↑ a b c Miaud, Claude; Guyétant, Robert; Elmberg, Johan. Variations in life-history traits in the common frog Rana temporaria (Amphibia: Anura): a literature review and new data from the French Alps. „Journal of Zoology”. 249 (1), s. 61–73, 1999-09. DOI: 10.1111/j.1469-7998.1999.tb01060.x. (ang.).
- ↑ Maurizio Simmaco, Giuseppina Mignogna, Silvia Canofeni, Rossella Miele, Maria Luisa Mangoni, Donatella Barra. Temporins, Antimicrobial Peptides from the European Red Frog Rana temporaria. „European Journal of Biochemistry”. 242 (3), s. 788–792, 1996-12. DOI: 10.1111/j.1432-1033.1996.0788r.x. (ang.).
- ↑ Smith CL. Seasonal Changes in Blood Sugar, Fat Body, Liver Glycogen, and Gonads in the Common Frog, Rana Temporaria. „Journal of Experimental Biology”. 26, s. 412–429, 1949-05-18. Company of Biologists. (ang.).
- ↑ a b K. Ingemar Jönsson, Gábor Herczeg, Robert B. O’Hara, Fredrik Söderman, Arnout F.H. Ter Schure, Per Larsson, Juha Merilä. Sexual patterns of prebreeding energy reserves in the common frog Rana temporaria along a latitudinal gradient. „Ecography”. 32 (5), s. 831–839, 2009-10. DOI: 10.1111/j.1600-0587.2009.05352.x. (ang.).
- ↑ Katarzyna Sidoruk, Agnieszka Czerwiec, Paweł Siwak: Wpływ wybranych czynników pogodowych na dynamikę wiosennych wędrówek płazów. Uniwersytet w Białymstoku. [dostęp 2010-08-25].
- ↑ a b W. Andrew Scott, David Pithart, John K. Adamson. Long-Term United Kingdom Trends in The Breeding Phenology of The Common Frog, Rana Temporaria. „Journal of Herpetology”. 42 (1), s. 89–96, 2008-03. DOI: 10.1670/07-022.1. (ang.).
- ↑ a b De Jongh, H.J. Functional Morphology of the Jaw Apparatus of Larval and Metamorphosing Rana Temporaria L. „Netherlands Journal of Zoology”. 18, s. 1–133, 1967. BRILL. DOI: 10.1163/002829668X00072. [zarchiwizowane z adresu 2013-09-29]. (ang.).
- ↑ a b c Anssi Laurila, Beatrice Lindgren, Ane T. Laugen. Antipredator defenses along a latitudinal gradient in Rana temporaria. „Ecology”. 89, s. 1399–1413, 2007-09-24. DOI: 10.1890/07-1521.1. [zarchiwizowane z adresu 2013-05-03]. (ang.).
- ↑ a b Anssi Laurila, Jutta Kujasalo. Habitat duration, predation risk and phenotypic plasticity in common frog (Rana temporaria) tadpoles. „Journal of Animal Ecology”. 68 (6), s. 1123–1132, 1999-11. DOI: 10.1046/j.1365-2656.1999.00354.x. (ang.).
- ↑ Laugen A.T.; Laurila A.;Räsänen K.; Merilä J. Latitudinal countergradient variation in the common frog (Rana temporaria) development rates – evidence for local adaptation. „Journal of Evolutionary Biology”. 16 (5), s. 996–1005, 2003-08. DOI: 10.1046/j.1420-9101.2003.00560.x. (ang.).
- ↑ W. Reh, A. Seitz, The influence of land use on the genetic structure of populations of the common frog Rana temporaria, „Biological Conservation”, 54 (3), 1990, s. 239–249, DOI: 10.1016/0006-3207(90)90054-S, ISSN 0006-3207 [dostęp 2023-02-03] (ang.).
- ↑ Johansson, Markus; Primmer, Craig R.; Merila, Juha. Does habitat fragmentation reduce fitness and adaptability? A case study of the common frog (Rana temporaria). „Molecular Ecology”. 16 (13), s. 2693–2700, 2007-06-02. DOI: 10.1111/j.1365-294X.2007.03357.x. (ang.).
- ↑ a b Chikako Matsuba, Ikuo Miura, Juha Merilä. Disentangling genetic vs. environmental causes of sex determination in the common frog, Rana temporaria. „BMC Genetics”. 9 (3), 2008. (ang.).
- ↑ a b Jussi S. Alho, Chikako Matsuba, Juha Merilä. Sex reversal and primary sex ratios in the common frog (Rana temporaria). „Molecular Ecology”. 19 (9), s. 1763–1773, 2010-05. Blackwell Publishing Ltd. DOI: 10.1111/j.1365-294X.2010.04607.x. (ang.).
- ↑ Paola Mensi, Aldo lattes, Biancamaria Macario, Sebastioano Salvidio, Cristina Giacoma, Emilio Baletto. Taxonomy and evolution of European brown frogs. „Zoological Journal of the Linnean Society”. 104 (4), s. 293–311, 1992-04. DOI: 10.1111/j.1096-3642.1992.tb00925.x. (ang.).
- ↑ Cunningham AA; Langton TES; Bennett PM; Lewin JF; Drury SEN; Goug RE; MacGregor SK. Pathological and microbiological findings from incidents of unusual mortality of the common frog (Rana temporaria). „Philosophical Transactions: Biological Sciences”, s. 1539, 1996. The Royal Society. (ang.).
- ↑ Christine T. Griffin. Oswaldocruzia filiformis (Nematoda: Trichostrongyloidea) in frogs (Rana temporaria) from three locations in Ireland. „Journal of Helminthology”. 63, s. 53–62, 1989. Cambridge University Press. DOI: 10.1017/S0022149X00008737. (ang.).
- ↑ O. Broza, M. Privora. Two skin parasites of Rana temporaria: Dermocystidium ranae Guyénot & Naville and Dermosporidium granulosum n.sp.. „Parasitology”. 42, s. 65–69, 1952. Cambridge University Press. DOI: 10.1017/S0031182000084286. (ang.).
- ↑ Maciej Arciszewski, Anna Suchowolec, Włodzimierz Chętnicki: Inwentaryzacja płazów i ich miejsc rozrodu w Nadmorskim Parku Krajobrazowym. Uniwersytet w Białymstoku. [dostęp 2010-08-25].
- ↑ Jon Loman, Björn Lardner. Does pond quality limit frogs Rana arvalis and Rana temporaria in agricultural landscapes? A field experiment. „Journal of Applied Ecology”. 43 (4), s. 690–700, 2006-08. DOI: 10.1111/j.1365-2664.2006.01172.x. (ang.).
- ↑ Dz.U. 2014 poz. 1348 Rozporządzenie Ministra Środowiska z dnia 6 października 2014 r. w sprawie ochrony gatunkowej zwierząt. [dostęp 2014-10-08].
- ↑ Rozporządzenie Ministra Środowiska z dnia 16 grudnia 2016 r. w sprawie ochrony gatunkowej zwierząt (Dz. U. z 2016 r., poz. 2183). [dostęp 2017-01-16].
- ↑ Grzegorz Hebda, Adam Kuńka, Renata Paszkiewicz, Rafał Szkudlarek. Czerwona lista kręgowców (płazy Amphibia, gady Reptilia, ptaki Aves, ssaki Mammalia) województwa opolskiego. „Nature Journal”. 37, 2004-09-10. [zarchiwizowane z adresu 2013-09-26].


 French
French Deutsch
Deutsch