Acido mevalonico
| Acido mevalonico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido 3(R)-3,5-diidrossi-3-metilpentanoico | |
| Abbreviazioni | |
| MVA | |
| Nomi alternativi | |
| diidrossimetilvalerolattone | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H12O4 |
| Massa molecolare (u) | 148,16 |
| Aspetto | solido (20 °C) |
| Numero CAS | |
| PubChem | 439230 |
| DrugBank | DBDB03518 |
| SMILES | CC(CCO)(CC(=O)O)O |
| Proprietà chimico-fisiche | |
| Coefficiente di ripartizione 1-ottanolo/acqua | -1 |
| Temperatura di fusione | 24 - 27 °C |
| Indicazioni di sicurezza | |
L'acido mevalonico è un composto chimico con formula chimica che a temperatura ambiente è presente in forma solida.[1]
Struttura e caratteristiche fisiche
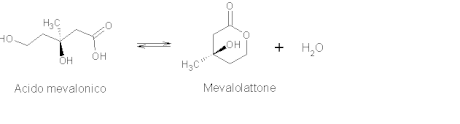
[modifica | modifica wikitesto]Si tratta di un composto organico idrosolubile, nello specifico di un acido idrossi-monocarbossilico, ovvero l'acido coniugato dell'R-mevalonato. Le forme isomere (R) e (S) a catena aperta sono in equilibrio con il lattone formato per reazione intramolecolare tra il gruppo carbossilico e il gruppo alcolico terminale, chiamato mevalonolattone. In ogni caso, l'acido mevalonico capostipite della via biosintetica omonima, ha configurazione R.[1]
Il composto presenta inoltre le seguenti caratteristiche:[1]
- 3 donatori di legami a idrogeno
- 4 accettori di legami a idrogeno
- 4 legami ruotabili
- massa monoisotopica = 148,07355886 g/mol
- superficie polare = 77.8Ų
- 10 atomi pesanti
- un elemento stereogenico
- rotazione ottica specifica = -20° a 20°C (sali ottenuti dalla reazione con benzene ed etere)
- sezione trasversale d'urto = 128 Ų [M+Na]+
Abbondanza e disponibilità
[modifica | modifica wikitesto]Il composto è naturalmente presente in diverse specie, incluso l'uomo, tra cui:
- Artemisia annua[2]
- asparago[3]
- Caenorhabditis elegans[4]
- Escherichia coli[5]
- liquirizia[6]
- piselli[7]
- pomodoro[8]
- Santalum album[9]
- Spinacia oleracea[10]
- Streptomyces lividans[11]
- Streptomyces anthocyanicus[11]
Reattività e caratteristiche chimiche
[modifica | modifica wikitesto]Il composto risulta solubile in acqua, e solventi organici, specialmente solventi organici polari. Sono disponibili diversi spettri per questo composto:[1]
- spettro 1H-13C NMR: picco principale a 1,36 ppm
- spettro MS-MS: cinque picchi, il principale a 148,91 m/z
- spettro LC-MS: cinque picchi, il principale a 65,085 m/z
Biochimica
[modifica | modifica wikitesto]Il composto è riconosciuto come elemento critico nella prenilazione di diverse proteine che regolano la crescita, incluse quelle della famiglia RAS.[12] Esiste inoltre una stretta correlazione tra i livelli plasmatici del composto e il tasso assoluto di secrezione dell'apolipoproteina B
Farmacologia e tossicologia
[modifica | modifica wikitesto]Farmacocinetica
[modifica | modifica wikitesto]Dopo somministrazione orale notturna, circa il 10% della dose è stata rinvenuta nelle urne dopo 12 ore.[13]
Farmacodinamica
[modifica | modifica wikitesto]Metabolismo
[modifica | modifica wikitesto]Nella seguente figura viene rappresentata la via metabolica che coinvolge l'acido mevalonico e porta alla sintesi di terpeni e steroidi:
Effetti del composto ed usi clinici
[modifica | modifica wikitesto]Il composto inibisce la sintesi del colesterolo.[1] È stato testato su pazienti affetti da ipercolesterolemia congenita eterozigota ottenendo una riduzione significativa dei livelli di colesterolo senza alcuna ripercussione sui livelli di LDH e trigliceridi.[14] Uno studio dimostra che l'applicazione a livello epidermico di acido mevalonico aumenta la resistenza ai danni e il tasso di recupero a seguito dell'interruzione della funzione di barriera.[15]
Note
[modifica | modifica wikitesto]- ^ a b c d e (EN) PubChem, Mevalonic acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 15 giugno 2024.
- ^ (EN) Linda Olofsson, Alexander Engström e Anneli Lundgren, Relative expression of genes of terpene metabolism in different tissues of Artemisia annuaL, in BMC Plant Biology, vol. 11, n. 1, 2011-12, DOI:10.1186/1471-2229-11-45. URL consultato il 15 giugno 2024.
- ^ (EN) Tae Gyu Yi, Young Rog Yeoung e Ik-Young Choi, Transcriptome analysis of Asparagus officinalis reveals genes involved in the biosynthesis of rutin and protodioscin, in Fengfeng Zhou (a cura di), PLOS ONE, vol. 14, n. 7, 22 luglio 2019, pp. e0219973, DOI:10.1371/journal.pone.0219973. URL consultato il 15 giugno 2024.
- ^ Michael Witting, Janna Hastings e Nicolas Rodriguez, Modeling Meets Metabolomics—The WormJam Consensus Model as Basis for Metabolic Studies in the Model Organism Caenorhabditis elegans, in Frontiers in Molecular Biosciences, vol. 5, 14 novembre 2018, DOI:10.3389/fmolb.2018.00096. URL consultato il 15 giugno 2024.
- ^ (EN) Douglas J. Pitera, Chris J. Paddon e Jack D. Newman, Balancing a heterologous mevalonate pathway for improved isoprenoid production in Escherichia coli, in Metabolic Engineering, vol. 9, n. 2, 2007-03, pp. 193–207, DOI:10.1016/j.ymben.2006.11.002. URL consultato il 15 giugno 2024.
- ^ (EN) Mrinalini Srivastava, Gaurav Singh e Swati Sharma, Elicitation Enhanced the Yield of Glycyrrhizin and Antioxidant Activities in Hairy Root Cultures of Glycyrrhiza glabra L., in Journal of Plant Growth Regulation, vol. 38, n. 2, 2019-06, pp. 373–384, DOI:10.1007/s00344-018-9847-2. URL consultato il 15 giugno 2024.
- ^ (EN) Lj Goad e Tw Goodwin, The biosynthesis of sterols in higher plants, in Biochemical Journal, vol. 99, n. 3, 1º giugno 1966, pp. 735–746, DOI:10.1042/bj0990735. URL consultato il 15 giugno 2024.
- ^ (EN) Prashant D. Sonawane, Jacob Pollier e Sayantan Panda, Plant cholesterol biosynthetic pathway overlaps with phytosterol metabolism, in Nature Plants, vol. 3, n. 1, 22 dicembre 2016, DOI:10.1038/nplants.2016.205. URL consultato il 15 giugno 2024.
- ^ (EN) Arti Rani, Puja Ravikumar e Manjunatha Damodara Reddy, Molecular regulation of santalol biosynthesis in Santalum album L., in Gene, vol. 527, n. 2, 2013-09, pp. 642–648, DOI:10.1016/j.gene.2013.06.080. URL consultato il 15 giugno 2024.
- ^ (EN) Ahmed Bakrim, Annick Maria e Fouad Sayah, Ecdysteroids in spinach (Spinacia oleracea L.): Biosynthesis, transport and regulation of levels, in Plant Physiology and Biochemistry, vol. 46, n. 10, 2008-10, pp. 844–854, DOI:10.1016/j.plaphy.2008.06.002. URL consultato il 15 giugno 2024.
- ^ a b (EN) Tomohisa Kuzuyama, Tohru Dairi e Haruyuki Yamashita, Heterologous Mevalonate Production in Streptomyces lividans TK23, in Bioscience, Biotechnology, and Biochemistry, vol. 68, n. 4, 2004-01, pp. 931–934, DOI:10.1271/bbb.68.931. URL consultato il 15 giugno 2024.
- ^ (EN) Susan E. Ownby e Raymond J. Hohl, Farnesol and geranylgeraniol: Prevention and reversion of lovastatin‐induced effects in NIH3T3 cells, in Lipids, vol. 37, n. 2, 2002-02, pp. 185–192, DOI:10.1007/s11745-002-0879-1. URL consultato il 15 giugno 2024.
- ^ (EN) Bernhard Lindenthal e Klaus von Bergman, Urinary excretion and serum concentration of mevalonic acid during acute intake of alcohol, in Metabolism, vol. 49, n. 1, 2000-01, pp. 62–66, DOI:10.1016/S0026-0495(00)90713-3. URL consultato il 15 giugno 2024.
- ^ Del Nero E, Aloe N, Augeri C, Avola F, Carta G, Cavagnaro A, De Grandi R, Gianfreda M, Magro GP, Mazzarello GP, et al., Valutazione clinica degli effetti ipocolesterolemizzanti di un inibitore della sintesi del colesterolo: l'acido mevalonico [The clinical evaluation of the hypocholesterolemic effects of an inhibitor of cholesterol synthesis: mevalonic acid], in Clin Ter., vol. 141, (7), luglio 1992, pp. 47-50.
- ^ (EN) Kenji Ikenaga, Norito Katoh e Shinya Hirano, Topical Mevalonic Acid Stimulates De Novo Cholesterol Synthesis and Epidermal Permeability Barrier Homeostasis in Aged Mice11The authors did not submit a completed declaration of conflict of interest form as requested by the JID’s ‘‘Information for authors’’., in Journal of Investigative Dermatology, vol. 114, n. 2, 2000-02, pp. 247–252, DOI:10.1046/j.1523-1747.2000.00875.x. URL consultato il 15 giugno 2024.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido mevalonico
Wikimedia Commons contiene immagini o altri file su acido mevalonico
| Controllo di autorità | NDL (EN, JA) 00563239 |
|---|


 French
French Deutsch
Deutsch